一、研究背景
二、研究手段
分别取86例tRCC样本的肿瘤(tumor)及癌旁正常组织(Normal adjacent tissues,NAT),提取蛋白进行蛋白质组及磷酸化蛋白质组学分析,提取DNA进行转录组及全外显子(whole-exome sequencing,WES)测序,后进行多组学联合分析。

图1 技术路线
三、研究结果
1、Mit家族tRCC多组学概览
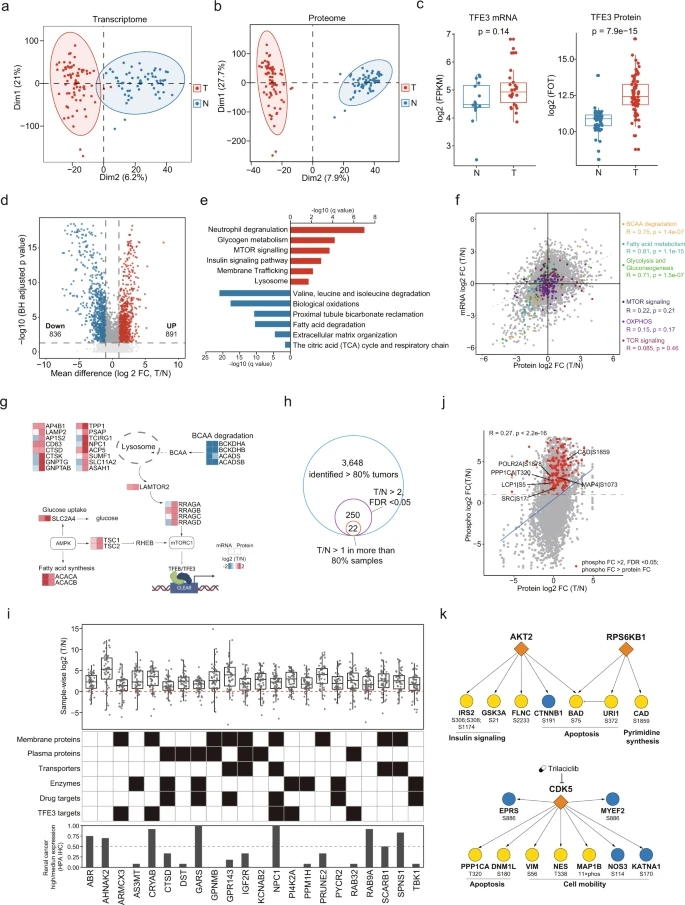
为了解tRCC于组学上的差异,分别进行Label-free蛋白质组学和磷酸化蛋白质组学分析,转录组测序及全外显子测序(图2a)。样本中位年龄为34岁,49例(57.0%)为I/II期肿瘤,36例(41.9%)为III/IV期肿瘤,分别有5例和63例TFEB型及TFE3型tRCC。TFEB中的融合类型有CLTC、ACTB、NEAT1和EIF4A2,而复发TFE3的融合类型主要包括ASPSCR1、SFPQ、NONO、PRCC、MED15、LUC7L3(图2b)。以癌旁正常组织为对照,筛选WES中的显著突变基因(significantly mutated genes,SMGs), BCDIN3D, NDRG1,ZNF668和GNPTG均为tRCC的SMGs(图2c)。本次样本共检测到14073种蛋白质,其中11471种蛋白质为肿瘤组织和NAT共有;共识别到33853个磷酸基,对应6469个蛋白(图2d,e)。本次共识别到7206对mRNA-蛋白质对,基因集富集分析(GSEA)表明,正相关的mRNA-蛋白质对应基因富集于肾脏升高蛋白、Gly/Ser/Thr代谢和细胞外基质(ECM)受体相互作用,而负相关的基因富集于蛋白酶体和氧化磷酸化(图2f)。

图2 Mit家族tRCC多组学景观
2.不同部位组织tRCC分子特征
为比较肿瘤组织和NAT的差异,进行分子特征比较分析。主成分分析的结果表明,两个部位的转录组和蛋白质组水平具有明显的差异(图3a,b)。肿瘤组织中,TFE3只在蛋白水平上调,而在mRNA水平上则没有(图3c)。鉴定到差异蛋白共1727个,相对NAT上调蛋白为891个,下调蛋白为836个(图3d)。对差异蛋白进行富集分析,结果表明,肿瘤中涉及中性粒细胞脱颗粒、mTOR信号通路和溶酶体功能等上调;脂肪酸降解、TCA循环和呼吸链等下调(图3e)。在mRNA和蛋白质水平上,多种代谢途径(包括氨基酸、脂肪酸和葡萄糖代谢)发生一致改变(图3f)。而mTOR信号通路和氧化磷酸化存在显著的mRNA和蛋白表达解耦(图3f,g)。严格筛选蛋白质数据后,拟22个候选tRCC生物标志物(图3h,i)。肿瘤组织有221个磷酸化位点显著上调,激酶底物富集分析(KSEA)的底物磷酸化水平可用于推断激酶活性,激酶RPS6KB1是mTOR信号传导的重要效应因子,其激活进一步支持了mTOR通路是tRCC的潜在治疗靶点(图3j,k)。
比较tRCC与其他RCC亚型,发现tRCC的肿瘤突变负担(tumor mutational burden,TMB)较低,染色体不稳定性(chromosome instability,CIN)最低。为研究内源性和外源性诱变对tRCC基因改变的贡献,使用非负矩阵分解分解了突变谱,与tRCC肿瘤中最匹配的突变特征是SBS26、SBS6、SBS40和SBS22。SBS6和SBS26与DNA错配修复(MMR)缺陷相关(图4a)。四个突变特征都与TMB显著相关,仅Sig2 (SBS6)与CIN显著相关,同时,SBS6和CIN与无进展生存期(progression free survival,PFS)不良相关(图4b,c)。在蛋白水平上研究SBS6的原因,发现DNA修复相关蛋白ATM、DDB1、PARP1、XRCC5和CUL4A在SBS6肿瘤中显著下调(图4d)。SBS6与氧化磷酸化呈负相关,于氧化损伤上相反(图4e)。受损的氧化磷酸化与tRCC肿瘤中氧化损伤的增加相关,证实了相关推断(图4f)。而SBS6肿瘤中受损的谷胱甘肽(GSH)合成相关酶(GSR, GSS, GCLC)进一步加强了SBS6与tRCC氧化损伤的相关性(图4g)。总之,SBS6特征的tRCC因线粒体功能障碍产生的ROS、GSH合成受损、DNA修复缺陷和DNA损伤增加导致进一步损伤的潜在传播(图4h)。
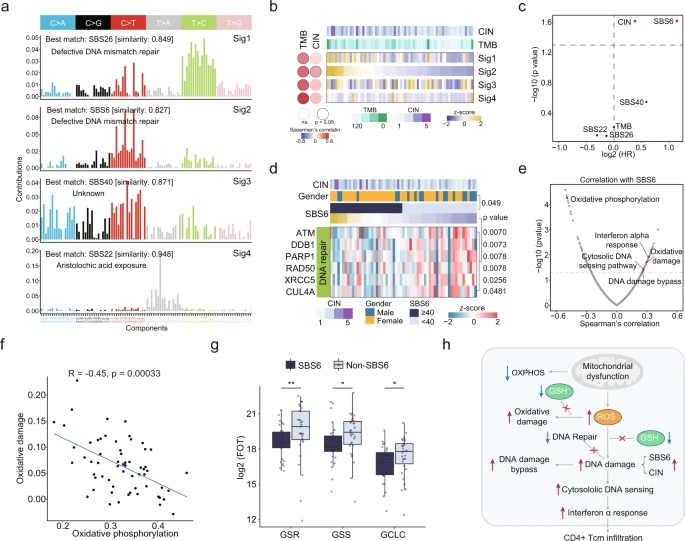
图4 突变特征和相关信号通路识别
4.体细胞拷贝数改变及其蛋白质组学影响
用GISTIC方法鉴定tRCC中的体细胞拷贝数变异(somatic copy number alterations,SCNA),本次共鉴定出14个臂级SCNA,其中包括1q、5p和5q增加,以及 4 q、9p和9q等的减少(图5a)。焦点SCNA结果显示,染色体1p的细胞带(1p13.2, 1p36.12, 1p36.21)包含最常缺失的焦点区域(图5b)。使用Cox回归来确定显著CNA与临床结果之间的相关性,结果表明,6q、18p、18q等的缺失以及1q和5p扩增显示较差的PFS(图5c)。染色体3p缺失展现较差的临床结果,GSEA结果显示,与3p拷贝数呈正相关的蛋白富集于聚集体自噬,呈负相关的蛋白富集于补体和凝血级联(图5d)。在3p缺失的肿瘤中观察到调节自噬的ULK1 S469上调,表明tRCC 中3p缺失会造成自噬失调(图5e)。此外,ATG7丰度与主要组织相容性复合体II(MHC-Ⅱ)的丰度呈正相关(图5f)。3p中另一个重要的顺式效应发生在钙粘蛋白-连环蛋白复合体CTNNB1中,钙粘蛋白-连环蛋白复合物大部分下调与较差的PFS有关(图5g)。钙粘蛋白-连环蛋白复合物在细胞粘附中起重要作用,它的下调会致使肿瘤转移发展。
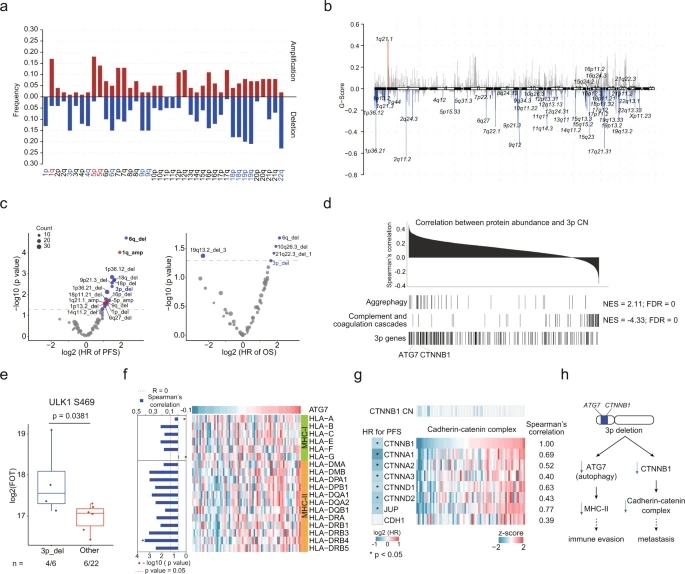
图5 tRCC体细胞拷贝数变异分析
5.不同tRCC融合类型的蛋白质组学差异
为研究不同tRCC亚型间的差异,对TFEB和TFEB进行蛋白质组学分析。TFE3型中有20个上调蛋白,TFEB型中有518个(图6 a)。TFEB在TFEB-trcc中尤其过表达,其对应活性也更强,而TFE3的丰度和活性没有显示出显著差异(图6 b,c)。富集分析显示TFEB-tRCC中糖酵解、糖异生、中性粒细胞脱颗粒、内吞作用、坏死和膜运输上调;在TFE3-tRCC中,钙调蛋白依赖性蛋白激酶活性上调(图6 d)。不同TFE3基因融合具有不同的蛋白质组学特征,ASPSCR1-TFE3 tRCC中,急性期反应(C1S, C1QC)和抗原呈递(TAP1, TAP2)上调,SFPQ-TFE3 tRCC在泛素-蛋白酶体系统(UBB, UBC, PSMB7)中显示升高(图6 e)。TFE3活性和肾脏特征评分在不同tRCC融合类型之间存在差异,与患者预后显著相关,SPSCR1-TFE3和LUC7L3-TFE3融合肿瘤具有更高的TFE3活性,而肾脏特征评分较低(图6 f,g)。ASPSCR1和LUC7L3融合比其他融合类型的肿瘤相比,显示较低的生存可能(图6 h)。
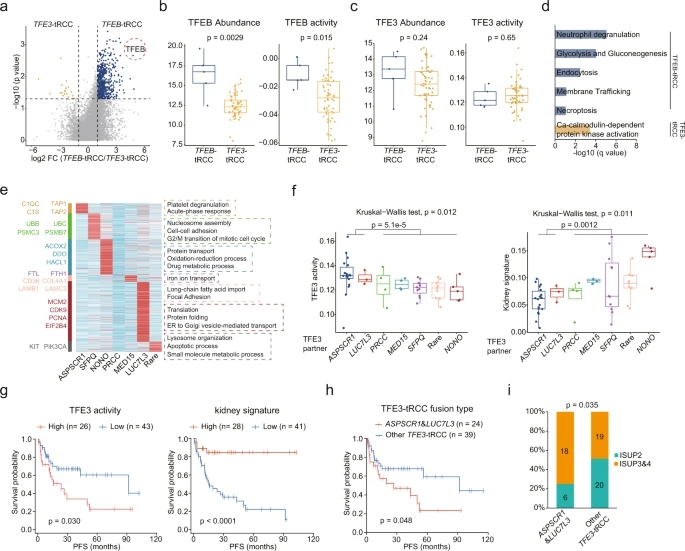
图6 tRCC不同亚型间的蛋白质组学差异
6.tRCC的蛋白质组亚型
由于肿瘤间具有高度异质性,对tRCC实施分子分型是必要的。基于蛋白质组学的数据,进行聚类分析,得到GP1、GP2、GP3共3种亚型。GP1的Ⅲ期和Ⅳ期肿瘤比例最高,而GP2的Ⅰ期和Ⅱ期肿瘤比例最高(图7a)。蛋白质组亚型在总生存期(overall survival,OS)和PFS上存在显著差异,GP1的OS和PFS最短,GP3的PFS较短,但OS较长(图7b)。对每个亚型中上调蛋白进行过表达分析,GP1上调蛋白在补体和凝血级联、血小板脱颗粒和先天免疫系统等途径中富集;GP2更多地与代谢途径升高相关;GP3模块中,与肿瘤增殖和蛋白质稳态相关的通路被富集(图7c)。对拷贝数变异进行探讨,结果表明,9q和14q的缺失在GP1中聚集,12p和12q的扩增在GP1和GP3中聚集(图7a,d)。对GP1中最常见的9q缺失进行GSEA分析,结果表明,补体激活在9q缺失的肿瘤中富集,而氧化磷酸化非9q缺失的肿瘤中富集(图7e)。ATP6V1G1 (9q32)编码ATP酶的一个组分,表现出显著的CNA顺式效应(图7f)。此外,ATP6V1G1丰度与临床结果显著相关(图7g)。
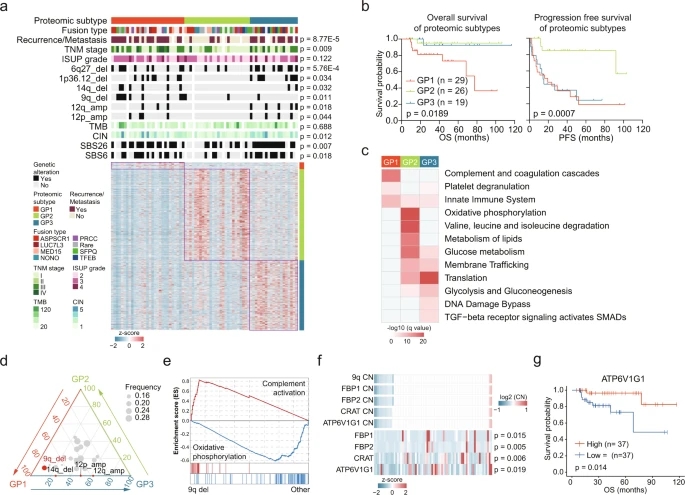
图7 基于蛋白质组学的tRCC分子分型
7、tRCC的免疫浸润特征
为了研究tRCC的免疫浸润特征,基于推测肿瘤微环境(tumor microenvironment,TME)中不同细胞类型的相对丰度,进行聚类分析,得到IM1、IM2和IM3共3种免疫亚型。免疫亚型与蛋白质分型有显著相关性,反映了TME对蛋白质表达模式的影响(图8a)。与蛋白质组学聚类一致,免疫亚型与临床结果显著相关,其中IM1的OS最低(图8b)。补体级联和上皮细胞间充质转化(EMT)水平在IM1肿瘤中增强,进一步证实TME中的成纤维细胞可以增强肿瘤细胞的EMT(图8c,d)。IM1肿瘤14q和9q缺失的频率较高,两者都与不良预后相关(图8e)。探究14q拷贝数对蛋白质的影响,结果显示,蛋白酶体最为相关,表现为19个蛋白酶体组分与14q 拷贝数间存在显著相关性(图8f,g)。由于蛋白酶体在蛋白质周转中起重要作用,进一步探究蛋白酶体与tRCC中蛋白质丰度之间的关系,结果表明,EMT相关蛋白丰度和EMT评分与蛋白酶体呈负相关(图8h,补充图7i(未显示))。综上所述,14q缺失调控了tRCC中EMT和IM1类微环境,与不良预后相关(图8i)。
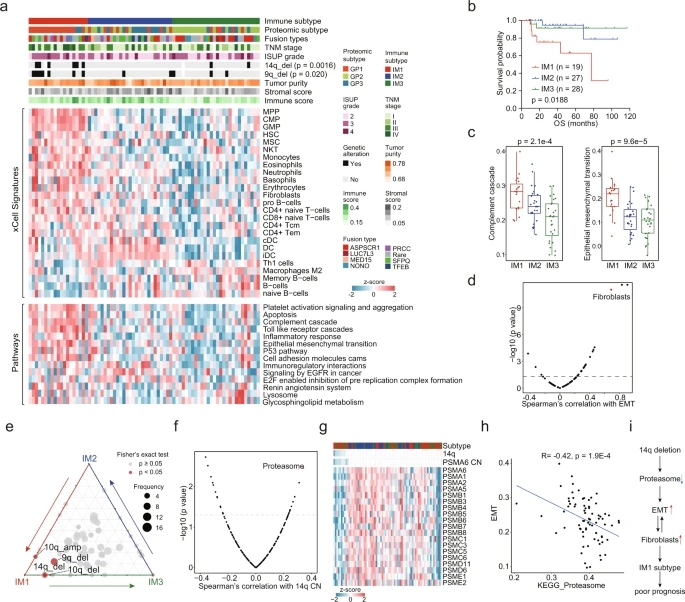
图8 tRCC的免疫浸润
四、结论
本次研究展示了tRCC肿瘤和正常邻近组织的综合蛋白质基因组分析,以阐明疾病的分子景观。DNA修复缺陷在tRCC的发生和发展中起着重要作用,代谢过程在mRNA和蛋白质水平上均明显失调,蛋白质组学和磷蛋白质组学数据确定mTOR信号通路是一个潜在的治疗靶点。此外,分子分型和免疫浸润分析表征了tRCC的肿瘤间异质性,多组学整合揭示了受基因组改变影响的细胞过程的失调,整体为tRCC的生物学机制、疾病诊断和预测提供了有价值的见解。
参考文献
Qu Y, Wu X, Anwaier A, et al. Proteogenomic characterization of MiT family translocation renal cell carcinoma. Nat Commun. 2022 Dec 5;13(1):7494.














