一、研究背景
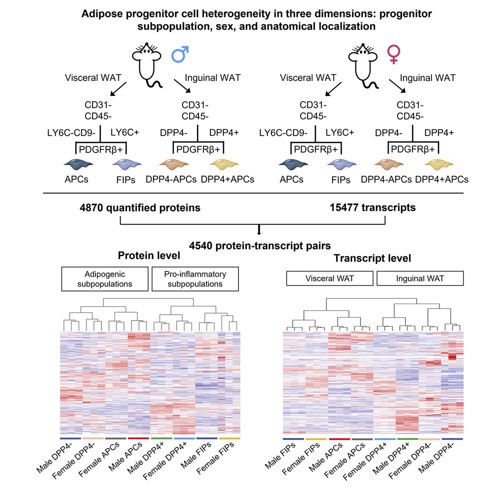
图1 技术路线
三、研究结果
1、蛋白质组学揭示脂肪组织祖细胞异质性
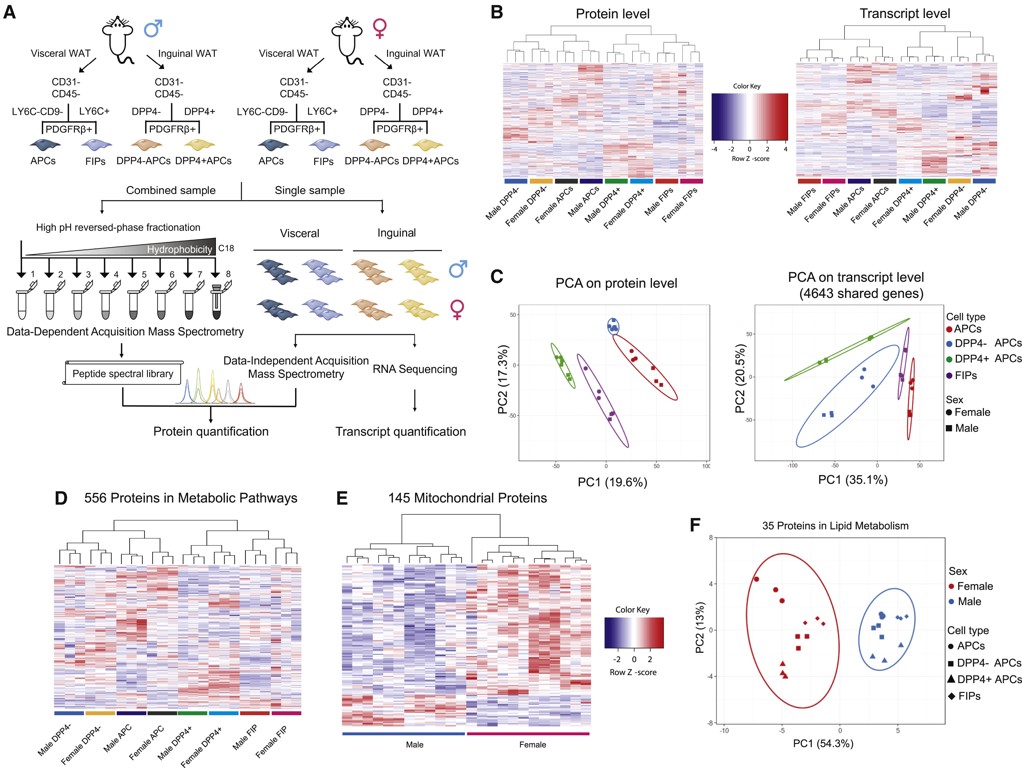
为探索脂肪组织不同细胞亚群的基因表达情况,对来自内脏白色脂肪组织(gWAT)的脂肪祖细胞(Adipose progenitor cell,APCs)、纤维炎症祖细胞(Fibro-inflammatory progenitors,FIPs )和来自腹股沟白色脂肪组织(iWAT)的PDGFRb+祖细胞(包含DPP4+及DPP4-)进行蛋白质组和转录组表征。本次共量化到4870种蛋白质和15477个转录本。聚类分析结果表明gWAT的APCs和FIPs及iWAT的APCs在转录组水平上更为相似(图2B)。gWAT的FIPs和iWAT的DPP4+APCs作为不同的集群,它们之间的相似度比各自储库中的相似度更高(图2C)。因此,蛋白水平上的基因表达似乎比来源或性别更能反映不同细胞群的功能异质性。蛋白质分析中有556种蛋白与代谢相关,并可以这些蛋白来区分不同的细胞亚群,表明这些亚群在稳态状态下的代谢存在根本差异(图2D)。此外,对受性别显著调控的蛋白进行GO分析,发现线粒体蛋白和脂代谢调控因子的表达存在明显的性别依赖性差异。富集于GO细胞成分术语“线粒体”中的145个蛋白和GO生物过程术语“脂质代谢过程”中的35个蛋白可明确区分性别(图2E、F)。综上,多组学分析为脂肪祖细胞分子和功能异质性的性别和储存依赖性差异提供了更深入的见解。
2.多组学揭示脂肪基质细胞中蛋白质-mRNA的相关性
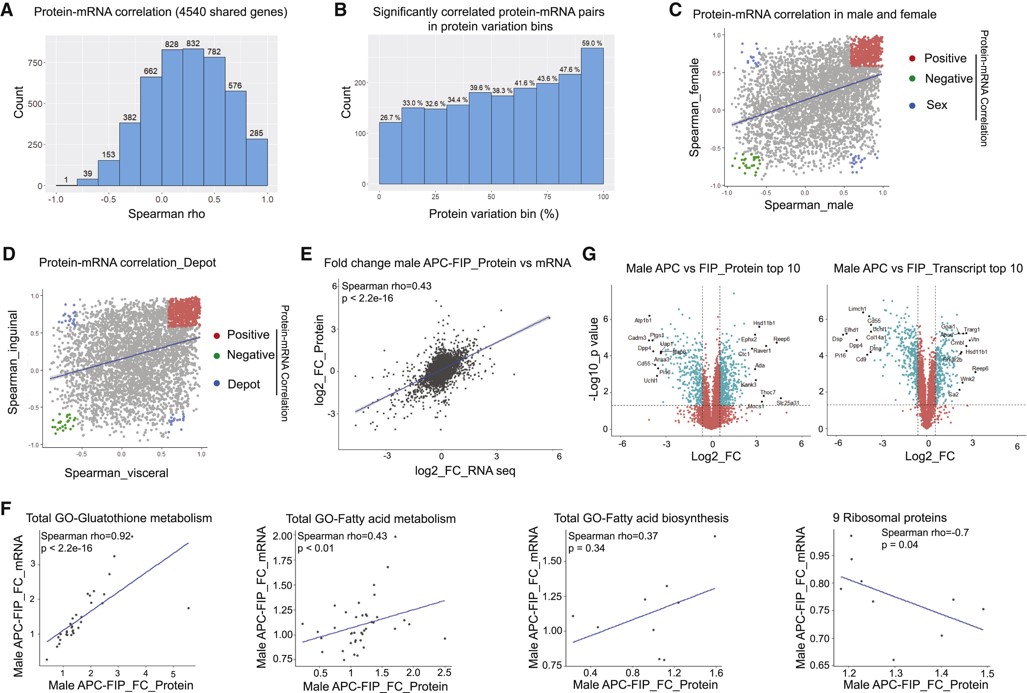
为探究不同祖细胞亚群蛋白质水平和mRNA水平之间的相关性,对转录组学和蛋白质组学数据集进行整合。对24个样本中共有4540个蛋白质-mRNA对进行了Spearman相关分析,1800个蛋白-mRNA具有显著意义(图3A)。根据蛋白质丰度CV将4540个共有基因划分为10个组,发现蛋白质-mRNA相关性与蛋白质水平的方差密切相关(图3B)。蛋白质-mRNA在不同性别群体中的分布结果显示,分别有1517和1160对蛋白质-mRNA在雄性和雌性群体中具有显著意义(图3C)。此外,有1425对在一个性别上存在显著性相关,但在另一个性别上不存在显著性相关,这表明蛋白质-mRNA相关性具有性别依赖性(图3D)。参与谷胱甘肽代谢的32个基因呈显著正相关,9个核糖体蛋白呈现负相关(图3F)。
3.蛋白质GSEA分析反映APCs分化性别差异
为深入挖掘蛋白质组与基因组的关系,进行基因集富集分析(GSEA)。结果显示,与WAT重塑相关的几种途径,包括“雌激素反应”、“通过NFκB传递TNFɑ信号”和“缺氧”。对这些数据的进一步检查显示,这些分子特征的差异表达在蛋白质水平上比在mRNA水平上更明显和一致(图4B-D)。蛋白质组学分析捕获了37个反映早期和晚期雌激素反应的蛋白质,几乎所有这些蛋白在雌性DPP4-APCs里的表达水平比雄性DPP4-APCs高(图4B)。值得注意的是,这些蛋白质可明显将雌性iWAT群体与其他群体区分开来(图4E)。
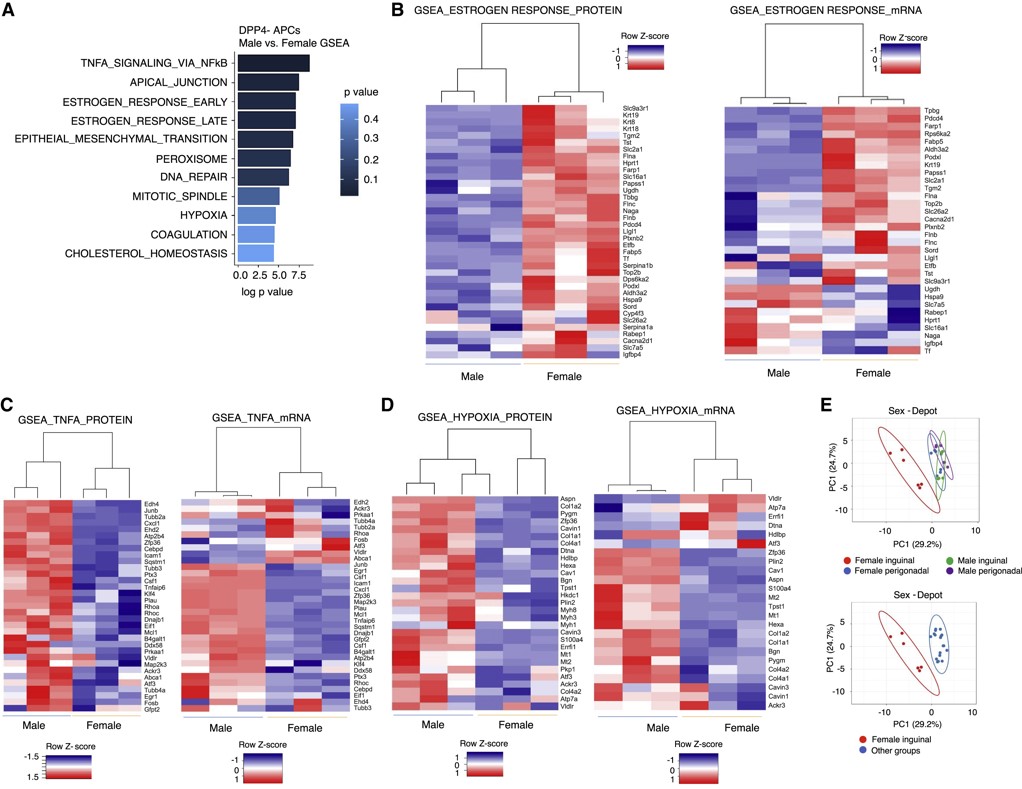
图4 不同性别APCs蛋白质组学GSEA分析
4.PPARγ磷酸化差异是iWAT APCs分化性别差异的基础
鉴于GSEA分析中“缺氧”富集,而缺氧诱导因子1ɑ(HIF1ɑ)对脂肪形成的主要调节因子PPARγ活性有抑制作用,即脂肪祖细胞内的HIF1ɑ激活触发PDGFR信号级联,驱动抑制性丝氨酸112 (S112)磷酸化PPARγ。构建转基因小鼠探究PPARγ磷酸化水平及高热量饮食中发生的新生脂肪形成是否存在性别差异,免疫沉淀结果显示,雌性iWAT PDGFRb+细胞中的磷酸化水平远低于雄性(图5A,B)。同等条件下,相较于雄性小鼠,雌性小鼠的新生脂肪显著增多,罗格列酮(PPARγ激动剂)处理后,进一步促进了雌性小鼠iWAT的脂肪生成(图5C-E)。平行谱系追踪实验表明,曲美替尼(MEK抑制剂)治疗使雄性小鼠iWAT脂肪生成优于罗格列酮治疗(图5F,G)。综上所述,表明PPARγ磷酸化差异是iWAT APCs分化性别差异的基础。
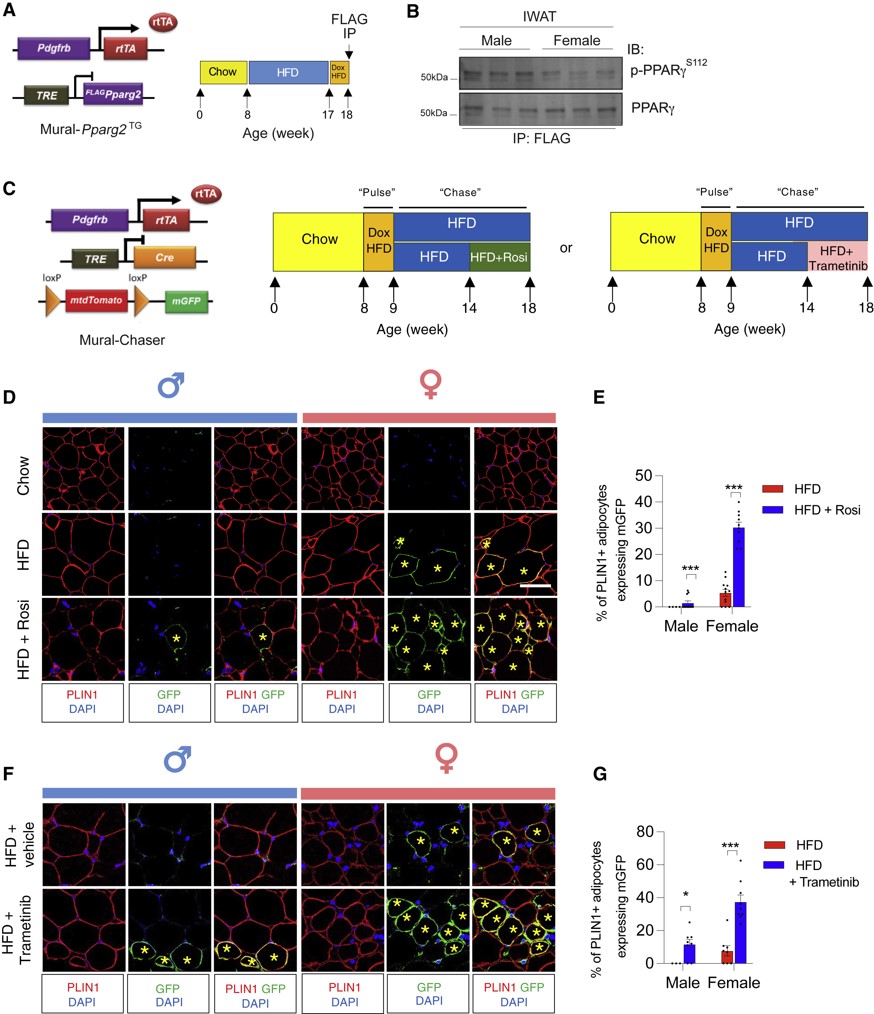
图5 不同性别PPARγ磷酸化水平及脂肪生成差异
5.功能注释确定控制gWAT APCs和FIPs的调控途径
基于前面的研究,APCs高度代表gWAT的前脂肪细胞,FIP表现出促炎的潜能,并调节与食源性肥胖(Diet-induced obesity,DIO)相关的免疫细胞稳态。GSEA分析表明,与雄性FIPs相比,APCs在与脂肪形成相关的通路中富集,且富含脂肪酸和胆汁酸代谢的特征,而“通过NFkB的TNFa信号”在雄性FIPs中显著富集(图6A,B)。IPA分析显示,18条通路在雄性APCs中得到富集,另外与肌动蛋白骨架及整合素信号通路相关的4条通路在FIPs中富集(图6C)。其中,谷胱甘肽介导的解毒和芳基烃受体信号通路(Aryl hydrocarbon receptor signaling,AhR)是雄性APCs蛋白水平上调最多的通路之一(图6D)。而AhR通路未在转录水平上体现。利用与谷胱甘肽介导的解毒和AhR通路有关的基因和蛋白甚至可以实现在两种水平上区分APC和FIP(图6E-H)。这些基因的蛋白水平与mRNA水平存在显著相关,但在蛋白水平上GSTM1的丰度最高,而在转录水平上Gpx3的丰度最高(图6E)。
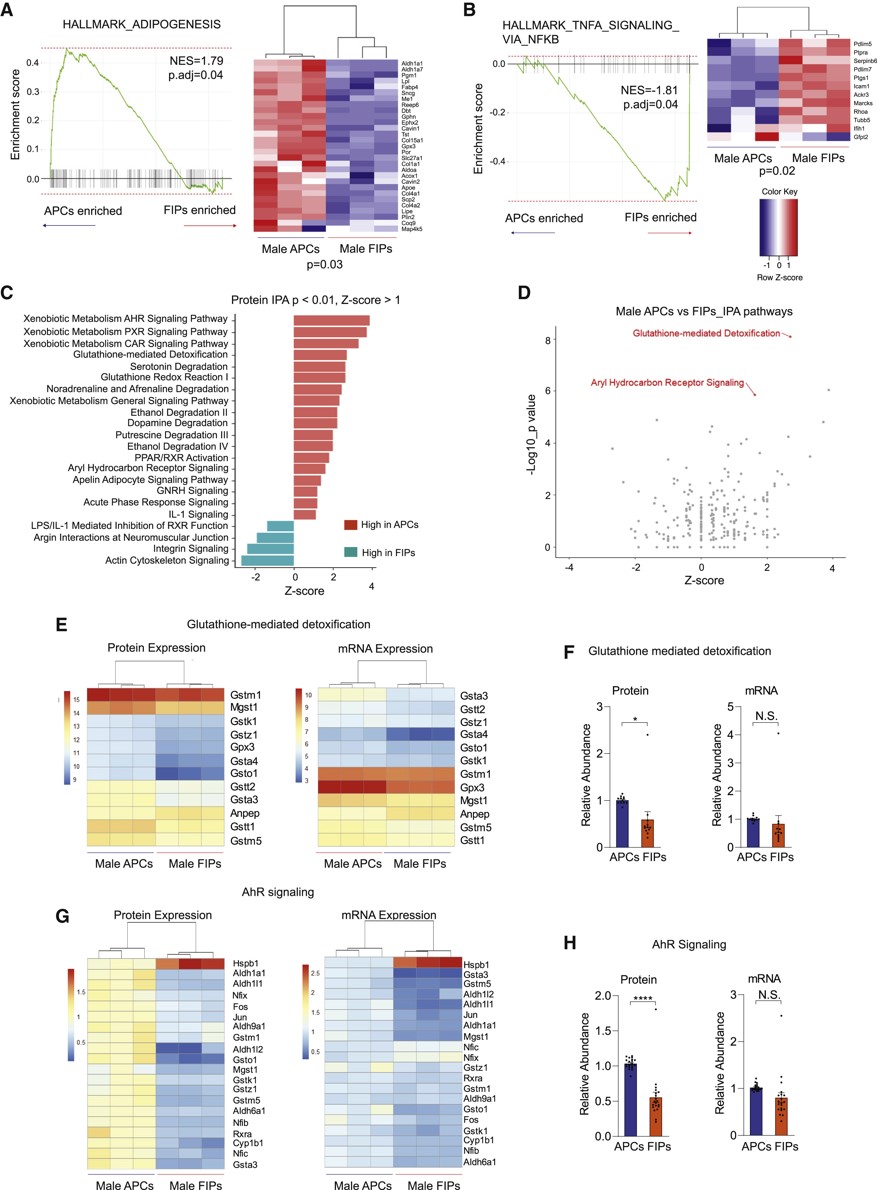
图6 雄性APC及FIP的GESA和IPA分析
6.GSTM1为细胞氧化还原平衡所必需
与雄性FIPs相比,男性APCs中参与谷胱甘肽(GSH)代谢的酶高度富集谷胱甘肽代谢控制细胞内氧化还原状态,对包括细胞分化在内的许多细胞过程至关重要。谷胱甘肽-s-转移酶(GSTs)参与GSH途径的氧化还原反应,从而调节细胞GSH:GSSG比值。在APC分化过程中,GSH:GSSG比值降低了70%,而于FIPs中下降程度要小得多(图7A)。为了验证维持低GSH:GSSG比值对脂肪形成的重要性,分离的APCs和FIPs用化学物质处理以改变GSH:GSSG比值(图7B)。用Diamide和BSO处理的APC显示出轻微但有统计学意义的成脂能力升高(图7C)。GSHest处理明显抑制APC的自发分化,在APC分化过程中,Gstm1的mRNA和蛋白稳步增加,而在FIPs中均相反(图7D-F)。使Gstm1失活,APC中的GSH:GSSG比值下降几乎完全被阻断,验证了Gstm1在控制细胞内氧化还原状态中是必不可少的(图7G-I)。GSTM1是gWAT APCs中细胞内谷胱甘肽代谢的主要酶。
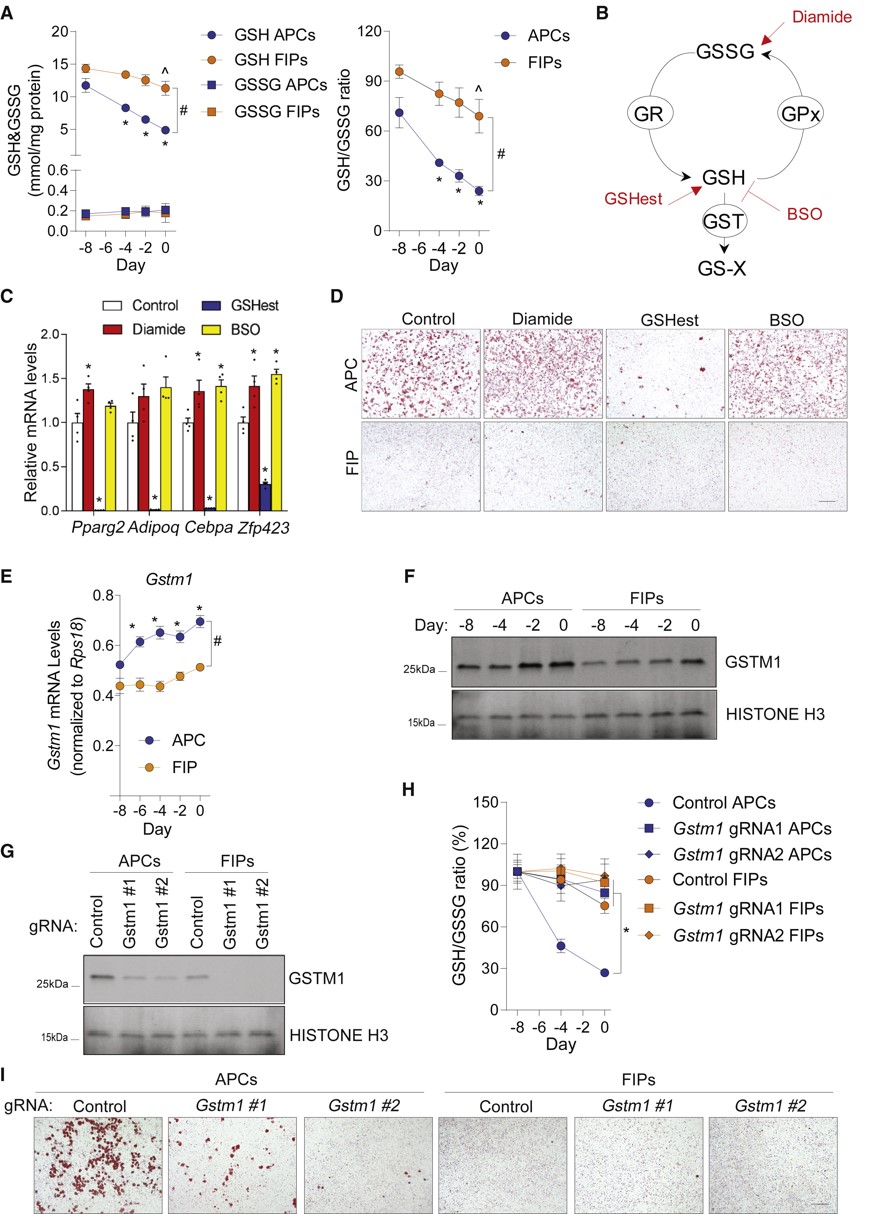
图7 Gstm1参与细胞内还原氧化的调控
7.AhR信号通路抑制FIPs和APCs的炎症反应
AhR是一种受体和转录因子,参与调节各种细胞类型的炎症反应,鉴于AhR在APC和FIP中的表达差异,对其进行研究。CRISPR-cas9敲除AhR,其表达及其转录靶点Cyp1b1相应降低,而相应的促炎基因Ccl2、Cxcl1、Cxcl2等表达显著升高,即AhR失活使APC和FIP对LPS刺激的促炎转录反应更加敏感(图8A-C)。对相应的培养基进行蛋白质组学检测,与转录组数据相符(图8 D)。将含LPS的AhR缺陷FIPs的培养基用于培养巨噬细胞,发现Ccl2、Il1b、Il6、Nos2和Tnfa(激活巨噬细胞的指标)的表达水平进一步升高,巨噬细胞被激活(图8 E)。AhR在控制性腺脂肪组织中PDGFRb+血管周围细胞的炎症反应中起着关键作用。
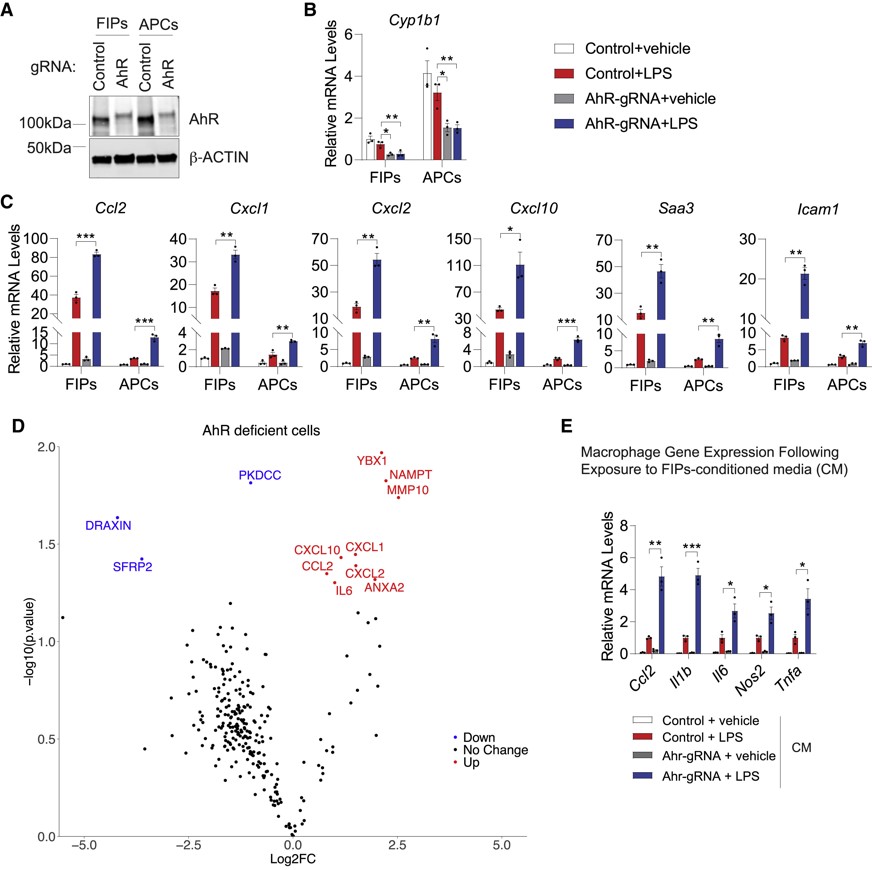
图8 AhR信号通路抑制APCs和FIPs的炎症反应
四、结论
脂肪祖细胞展现不同的特性,一定程度上来说可依据特性对脂肪祖细胞的来源或性别作出区分,而PPARγ磷酸化差异是iWAT APCs分化性别差异的基础,谷胱甘肽介导的解毒和AhR通路调控gWAT APCs和FIPs,与谷胱甘肽代谢相关的GSTM1调节细胞的氧化还原稳态,AhR通路可抑制炎症反应。本文结合蛋白质组学和转录组学揭示了脂肪祖细胞的异质性,很好地弥补了单组学研究存在片面的缺点,拓展了多组学联合分析的应用。
参考文献:
Shan B, Barker CS, Shao M, Zhang Q, Gupta RK, Wu Y. Multilayered omics reveal sex- and depot-dependent adipose progenitor cell heterogeneity. Cell Metab. 2022 May 3;34(5):783-799.e7.














