导读
真核细胞高度区室化,生物过程被分隔在不同的区室进行。蛋白质功能与亚 细胞定位密切相关,不同的区室提供不同的化学环境(例如pH和氧化还原条件)、不同的潜在作用配体或底物。因此,对蛋白质亚细胞定位的严格控制是细胞生理学的重要调控内容。
大多数细胞生物学过程涉及蛋白质亚细胞定位的改变,如转录因子的核胞质穿梭、凋亡过程中线粒体蛋白的重新定位以及细胞表面货物受体和信号受体的内吞摄取。相反,蛋白质的定位错误经常与细胞功能障碍和疾病有关,包括神经退行性变、癌症和代谢紊乱等,因此,了解蛋白质在亚细胞水平上的空间分布和捕获蛋白质亚细胞动力学的能力对于全面理解细胞生物学至关重要。
以蛋白质空间定位为研究方向的空间蛋白质组现在已经用于揭示人类蛋白质组的复杂结构,包括单细胞变异(在蛋白质水平和定位上)、动态蛋白质易位、改变相互作用网络和多个区室的蛋白质定位(这意味着潜在的“兼职”活动)。全局量化数据的结合使细胞模型的构建和系统分析能够超越定性描述。一些研究者也已成功运用空间蛋白质组学来研究疾病,包括急性病毒感染和肝病,或阐明单基因疾病背后的细胞缺陷。目前已经达到了空间蛋白质组学最终与其他“组学”技术、细胞生物学和医学研究相结合的地步,从而为生物过程提供无偏见的系统层面的见解。目前可用的空间蛋白质组学方法是高度互补的,它们各自的发展优势和局限性使它们适合于不同类型的应用。
空间蛋白质组学研究方法
空间蛋白质组学采用了三种互补的方法:分离细胞器的质谱分析、蛋白质-蛋白质相互作用网络分析和蛋白质组范围内的蛋白质定位成像。
1 基于质谱的细胞器分级方法
对于具有特征大小、密度和形状的均匀隔间,可以实现大量的富集(如突触囊泡)。但现在普遍认为,由于其固有的异质性和重叠的物理性质,大多数亚细胞隔室不适合真正的“纯化”。因此,在目标细胞器富集的部分检测蛋白质不足以证明其特异性的细胞器的结合。如图1a所示,传统分级方法是通过定制的亚细胞分级分离(如,梯度离心或差速离心)来富集目标细胞器(绿色)。然后利用质谱方法只分析富集到的组分,此方法鉴定出来的蛋白质包含目标细胞器蛋白和共富集污染物(红色和蓝色),但无法区分。
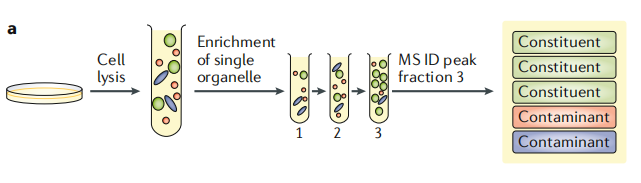
图1a 传统细胞器分级分析方法
1.1 单细胞器分析法
细胞器分析的基本策略是进行量身定制的生化分离,以对特定的细胞器进行富集,然后使用MS对富集方案的不同步骤中的蛋白质进行量化。如图1b所示,利用定量质谱方法对目标馏分和某几个相邻或相近馏分进行检测,每种蛋白质都可获得丰度分布曲线,再通过统计分析区分污染物(红色和蓝色),污染物可被识别,但却不一定能分解为不同的类别。该方法专注于单一的细胞器,通常适合解决有针对性的研究问题。
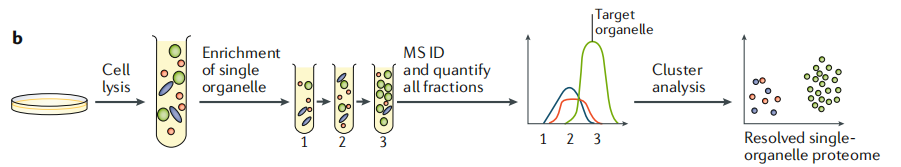
图1b 基于质谱的单细胞器分析法
1.2 多细胞器分析法
图1c为多细胞器分析法的分析流程,应用亚细胞分级方案,同时分离所有的细胞器。由于没有进行细胞器“纯化”,因而细胞器很大程度上重叠分布。之后对亚细胞分级进行定量质谱分析。每个细胞器都有自己独特的蛋白轮廓,通过对蛋白聚类分析,并使用已有的细胞器标记,对聚类蛋白进行注释。最后,标记谱可整理为一个分类算法(如支持向量机或神经网络)来预测非标记蛋白的隔间关联。研究结果是一个详细的细胞器图,可表明定量蛋白的亚细胞定位。
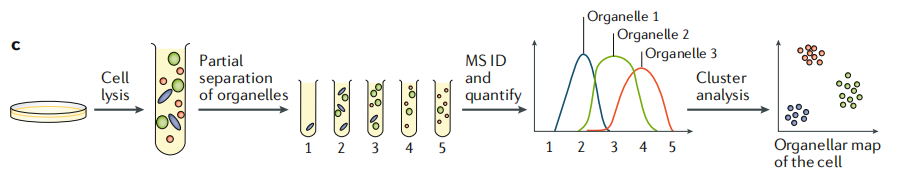
图1c 基于质谱的多细胞器分析法
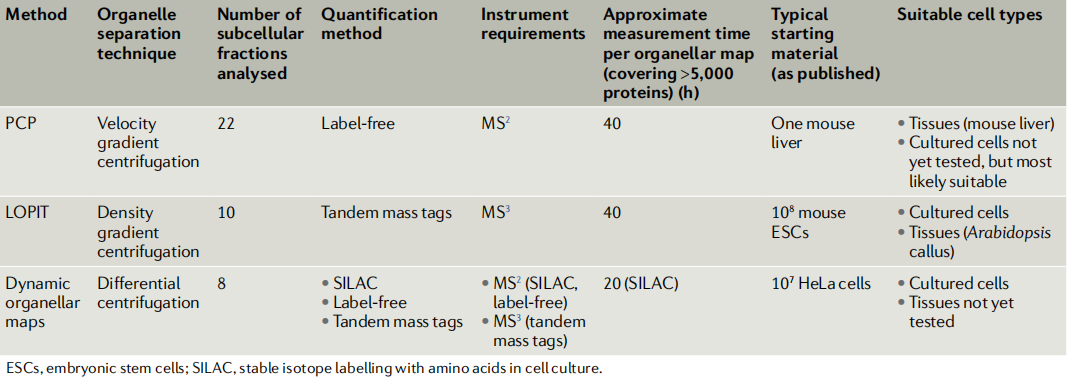
目前基于多细胞器分析的质谱方法,在细胞器分离方法、质谱定量策略,以及生物信息分析方法上,衍生出多种技术改进方案。不论何种方案,过去3年发表的多细胞器分析的应用中,都实现了非常高水平的细胞器分辨率(≥10个亚细胞区室)、蛋白质组学覆盖率(> 5000个蛋白质),以及分类的准确率(通常> 90%)(表 1)。
表1 基于质谱的多细胞器分析的当前实施方式
另外值得一提的是,由于质谱的高分辨率,细胞器质谱图本质上提供了大量潜在的相互作用的组学数据。如作为同一复合物的蛋白质在细胞器图谱上显示为微团簇,这一特征可用于鉴定新型蛋白质复合物(图1d)。此外,细胞器图谱原则上可提供肽段水平的分辨率(图1e),并揭示不同的蛋白质剪接体、蛋白水解加工形式,以及与翻译后修饰相关的多种定位差异。随着质谱技术的进一步发展,基于肽水平的细胞器定位可能会为解开蛋白质亚细胞定位的复杂性做出重大贡献。

图1de 用于新型蛋白质复合物的鉴定和提供肽段水平的分辨率的空间蛋白质组学
1.3 实例应用
1)表皮生长因子(EGF)信号传导模型
对未处理或用EGF刺激20min的HeLa细胞生成动态细胞器图。我们检测到大量的蛋白易位,包括EGF受体(EGFR)的内吞作用,信号蛋白(GRB2和SHC1)向EGFR的募集,以及下游靶转录因子(ERK2和RPS6K)的核穿梭。结合绝对蛋白质定量可以估计每个平均细胞检测到的易位的蛋白质数目。
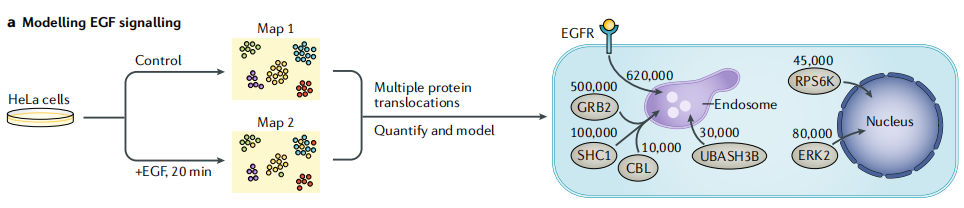
图2a 基于质谱的空间蛋白质组学方法研究表皮生长因子(EGF)信号传导模型
2)研究由适配器蛋白4(AP-4)复合物缺陷综合征引起的神经退行性变
编码AP-4亚基的基因突变会通过一种未知的机制导致严重的智力残疾、轴突变性和痉挛性截瘫。动态细胞器图谱的应用显示,在AP-4缺陷的细胞中,关键的自噬蛋白ATG9A被特异性地保留在反式高尔基网络(TGN)中。该疾病的一种新模型是,在神经元中,AP-4介导ATG9A从TGN到远端轴突的选择性运输,以调节局部自噬小体的形成,这对神经元内稳态至关重要。
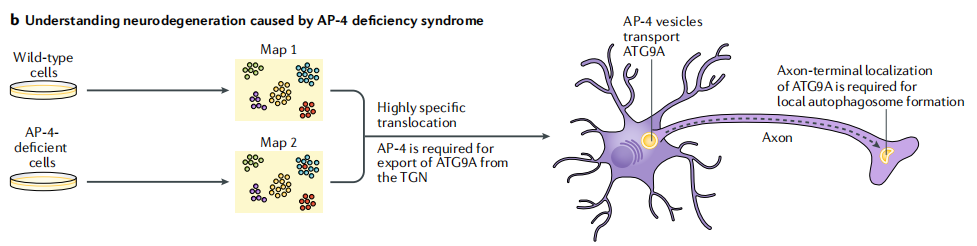
图2b 基于质谱的空间蛋白质组学方法研究神经退行性变的机制
3)研究肝脂肪变性的细胞变化
给小鼠喂食正常饮食或高脂肪饮食,以诱导肝脂肪变性,这是非酒精性脂肪肝(NAFLD)的一个标志。生成蛋白质相关谱图来监测肝脏中蛋白质的亚细胞易位。关键的观察结果包括许多接触位点蛋白重新定位到脂滴(LDs),高尔基体在LDs上的吸附和随后的分泌缺陷,这为NAFLD中肝细胞功能的降低提供了潜在的分子机制。
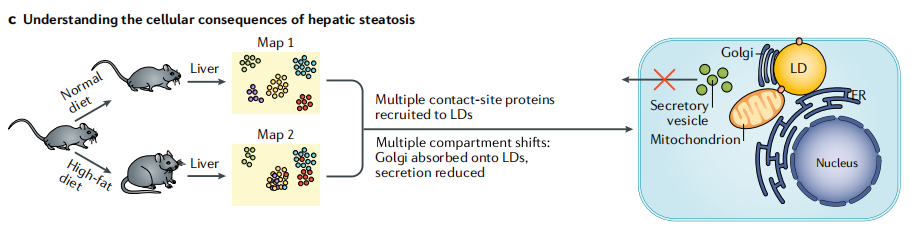
图2c 基于质谱的空间蛋白质组学方法研究肝脂肪变性的细胞变化
4)监测人巨细胞病毒(HCMV)感染期间的细胞反应
人原代成纤维细胞感染HCMV后,在120小时的时间过程中,每24小时通过同位素标记(LOPIT)图谱定位细胞器蛋白,跟踪细胞器重排。该分析揭示了与病毒增殖和细胞器重排相关的单个蛋白质易位。
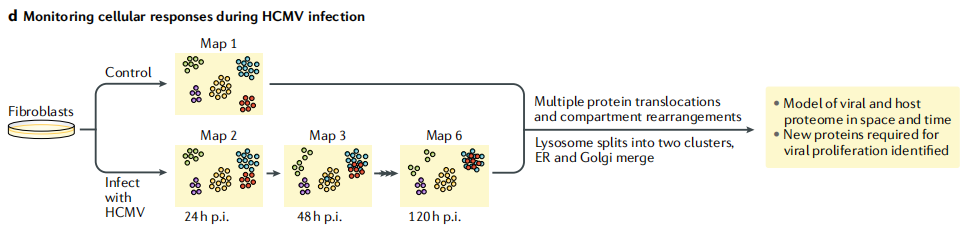
图2d 基于质谱的空间蛋白质组学方法监测人巨细胞病毒(HCMV)感染期间的细胞反应
2 基于蛋白互作网络的空间蛋白质组学
通过抗体介导的亲和纯化-质谱(AP-MS)实验,质谱已被广泛用于定义蛋白质-蛋白质相互作用。使用抗体从复杂样本(如全细胞裂解物)中亲和纯化蛋白质及其结合配体,后续通过MS分析鉴定(图3a)。从概念上讲,由于相互作用的蛋白必须位于相同的亚细胞位置,所以蛋白质的相互作用组可以认为是“局部”的空间蛋白质组。使用相互作用的诱饵蛋白进行多个AP-MS实验,也可以揭示一个具有空间信息的蛋白关联网络(图3b)。
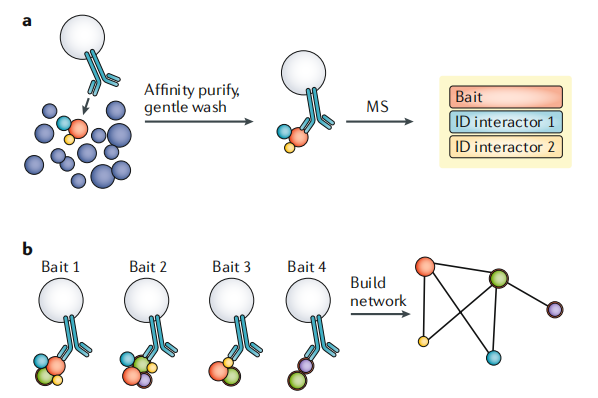
图3ab 通过蛋白互作网络研究空间蛋白质组学
邻近标记法对于细胞器的AP-MS十分有帮助。诱饵蛋白可以使用人工合成的抗坏血酸过氧化物酶(APEX)或生物素连接酶(BioID)进行标记。生物素连接酶可以催化诱饵蛋白紧邻(<10-20nm)蛋白质的生物素化。因而质谱分析的靶标蛋白不仅包括诱饵蛋白、与诱饵蛋白直接结合的配体,还包括瞬时相互作用的蛋白,以及位置紧密相连但不直接结合的蛋白(图3c)。由于少量诱饵蛋白便可获取丰富的空间信息,因而此方法可以在不需要亚细胞分级的情况下获得全面的区室蛋白质组(图3d)。
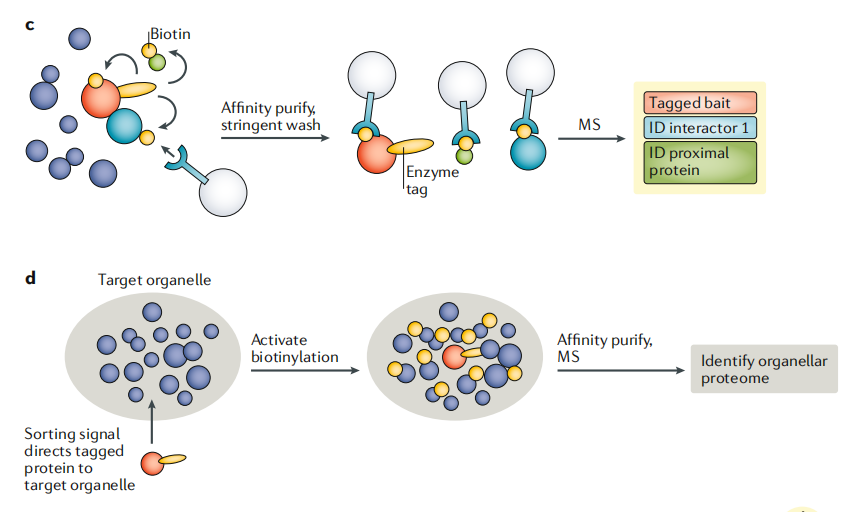
图3cd 基于邻近标记法的AP-MS
当在同一系统中进行多个AP-MS 或邻近标签标记实验时,诱饵蛋白和结合配体会在不同实验中重复出现(如在b部分中)。来自相同亚细胞定位的多个诱饵蛋白会揭示各个区室的详细图谱,而区室与区室又通过相互间的映射连接,最终便可以构建细胞全部亚细胞区室的空间蛋白质图谱(图 3e)。实现这一目标的方法是建立一个从18个亚细胞定位的细胞器“背景”生物ID蛋白质组数据库,为每个隔室使用一个已建立的标记蛋白。这个数据库虽然不是详尽的,但已经可以作为一个参考网格,仅从AP-MS数据中预测蛋白质的亚细胞定位,基于对已知的相互作用者的位置进行评分。
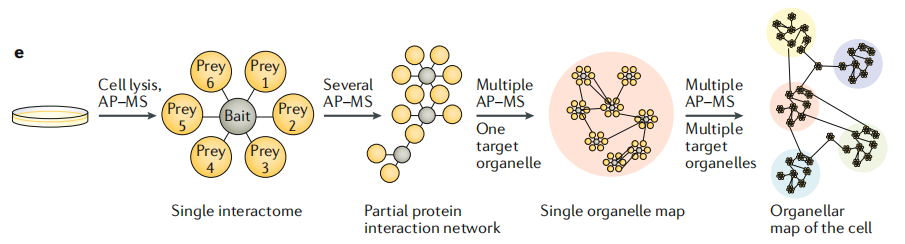
图3e 多个AP-MS或邻近标签标记实验的空间蛋白质组学研究
3 基于成像的空间蛋白质组学
基于成像的空间蛋白质组学提供了在自然细胞环境下可视化研究蛋白质的机会,而不需要在蛋白质组学分析之前进行细胞裂解或细胞器的分离(图4)。 基于成像的蛋白质定位便于研究具有多模式细胞器定位的蛋白质研究,实际上大多数的蛋白质也是定位于多个亚细胞区室的。此外,越来越多的研究表明,遗传背景相同的细胞群体也会在蛋白表达水平、蛋白定位上表现为差异。基于成像的空间蛋白质组学技术有助于通过捕获单细胞分辨率下的蛋白空间分布来研究这种可变性。蛋白质的可视化成像,通常使用抗体,或荧光蛋白的融合表达来实现。
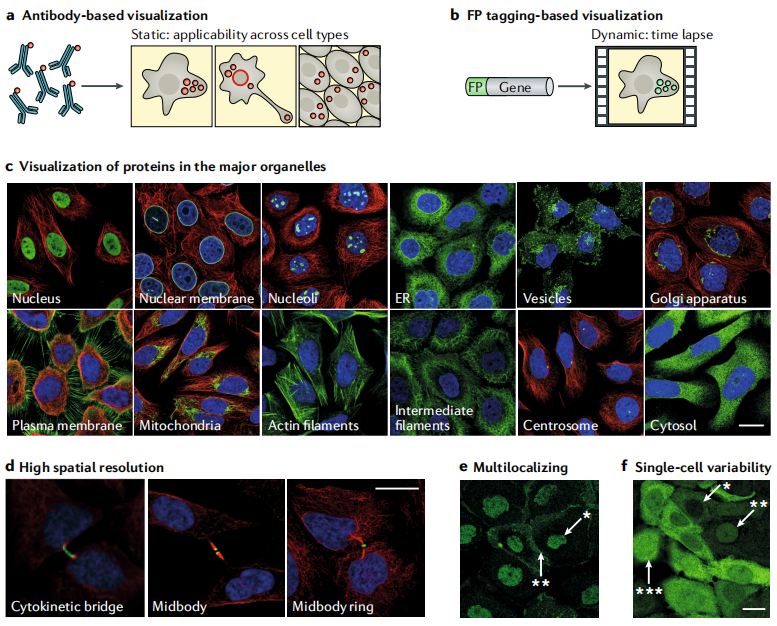
图4 基于成像的空间蛋白质组的多种处理方式
空间蛋白质组学未来的机遇与挑战
许多因素使得细胞蛋白质组比仅从基因数目进行的蛋白预测,要复杂的多。空间蛋白质组则最有希望解开这种有趣的细胞复杂性。
识别多重定位和“兼职”的蛋白质
研究表明,约50%的人类蛋白质组定位于多个亚细胞区室,这一观察结果提出了许多问题,比如不同的蛋白质种群是静态的还是动态的,它们的细胞分类是如何实现的,不同的种群是否对应于不同的蛋白质形式,最重要的是,这些蛋白质是否具有环境特异性的功能(即兼职活动)。“兼职”蛋白被定义为具有两种或两种以上不同细胞功能的蛋白质,这些功能不是由遗传变异、RNA剪接或多效性效应,而是由亚细胞定位、底物、寡聚化或翻译后修饰(PTMs)的差异引起。已知的兼职蛋白质的数量正在迅速增加,数据库列出了近700种具有两个特征独立功能的蛋白质,据估计,23%的人体蛋白是兼职蛋白,其中78%的已知兼职蛋白参与了疾病的发生发展,48%是目前的药物靶点,这强调了兼职对细胞功能的重要性。基于成像的空间蛋白质组学将是识别多定位蛋白的关键技术,以便更好地理解它们在作为细胞功能基础的复杂自适应系统的空间协调中的关键作用。
发现多种蛋白质存在形式(Proteoforms)
蛋白质的每种分子形式都称之为一种蛋白质形式,这种变化主要是由于DNA序列的变异性,RNA剪接和不同的翻译后修饰,如磷酸化,泛素化,烷基化和糖基化所引起的。据估计,一个典型的人体细胞包含600万个共存的蛋白质形式,虽然这个数字远低于理论上可能的组合数量,但它揭示了蛋白质组的巨大复杂性。基于质谱的空间蛋白质组学,可以提供关于蛋白质存在形式和亚细胞定位的新见解,并将为蛋白质形态复杂性尚未被探索的功能意义提供关键支撑。
获取蛋白质丰度信息
人类细胞中的细胞蛋白质丰度跨越了7个数量级,为了模拟细胞的生物学过程,需要了解每个细胞的绝对蛋白的数目及其变化,而基于质谱和成像的空间蛋白质组学可以提供这些信息。
获取单细胞变异信息
基因相同的细胞群体在蛋白质表达上会表现出不同的变化,例如在细胞分化过程中和对环境波动或药物的反应。我们对这种细胞异质性的理解仍然是初级的,基于成像的方法可能在阐明致病因素方面发挥关键作用,如随机性、微环境、细胞状态等。值得注意的是,目前已有科学家研究单细胞蛋白质组学。
获取蛋白质定位的动态信息
蛋白质亚细胞定位受到严格控制,许多蛋白质在刺激、扰动或疾病中改变定位。全球比较空间蛋白质组学,无论是基于成像的、基于相互作用的还是基于MS的,都是在系统水平上捕获这些生理和病理蛋白质易位的理想工具,并应该成为细胞生物学家广泛的发现工具。
总之,基于质谱与成像的空间蛋白质组有助于全面了解细胞的复杂性,而且空间蛋白质组学与其他组学的结合,也将利于发现更多的生物信息。深入了解不同细胞调控层之间的串扰,从而加深对细胞表型和活动型的认识。
小牟有话说
文章介绍了空间蛋白质组学的相关研究方法以及未来的机遇挑战,正是当前新兴的组学研究方法,也是小牟一直在从事以及探索的领域呢,如果您对空间蛋白质组学有兴趣,记得联系小牟哦。















