本期解读

一、研究背景
阿尔茨海默病(AD)是一种普遍存在的神经退行性脑疾病,它影响着全球约4400万人。虽然AD目前的特征是大脑中存在淀粉样蛋白-β(Aβ)斑块和tau神经纤维缠结,但在疾病进展过程中,除Aβ和tau蛋白沉积之外的分子和细胞变化仍然难以捉摸。近年来,在细胞间发挥重要通讯作用的细胞外囊泡(EV)正成为疾病诊断、预后和治疗的热点。

二、研究结果
1.hiPSC衍生脑细胞的分化和表征
作者首先用人类诱导多能干细胞(hiPSC)分化成四种神经细胞类型:星形胶质细胞(iAstrocyte)、小胶质细胞(iMGL)、神经元(iNeuron)和少突胶质细胞(iOligo)(图1a),并通过功能实验和RT-PCR验证分化的可靠性(图1b-图1f)。此外,利用非标定量质谱分析四种神经细胞的蛋白质组学,共鉴定了3206种蛋白质,其中,198种蛋白质是iNeuron独有的,239种是iMGL独有的,73种是iAstrocyte独有的,47种是iOligo独有的(图1g)。此外,一些常见的细胞类型特异性蛋白标志物分别在iNeuron(如MAPT)、iMGL(如AIF1、PU.1)、iAstrocyte(如AQP4)和iOligo(如OLIG2)中含量丰富(图1h)。以上结果揭示了hiPSC有效分化为主要脑细胞类型。
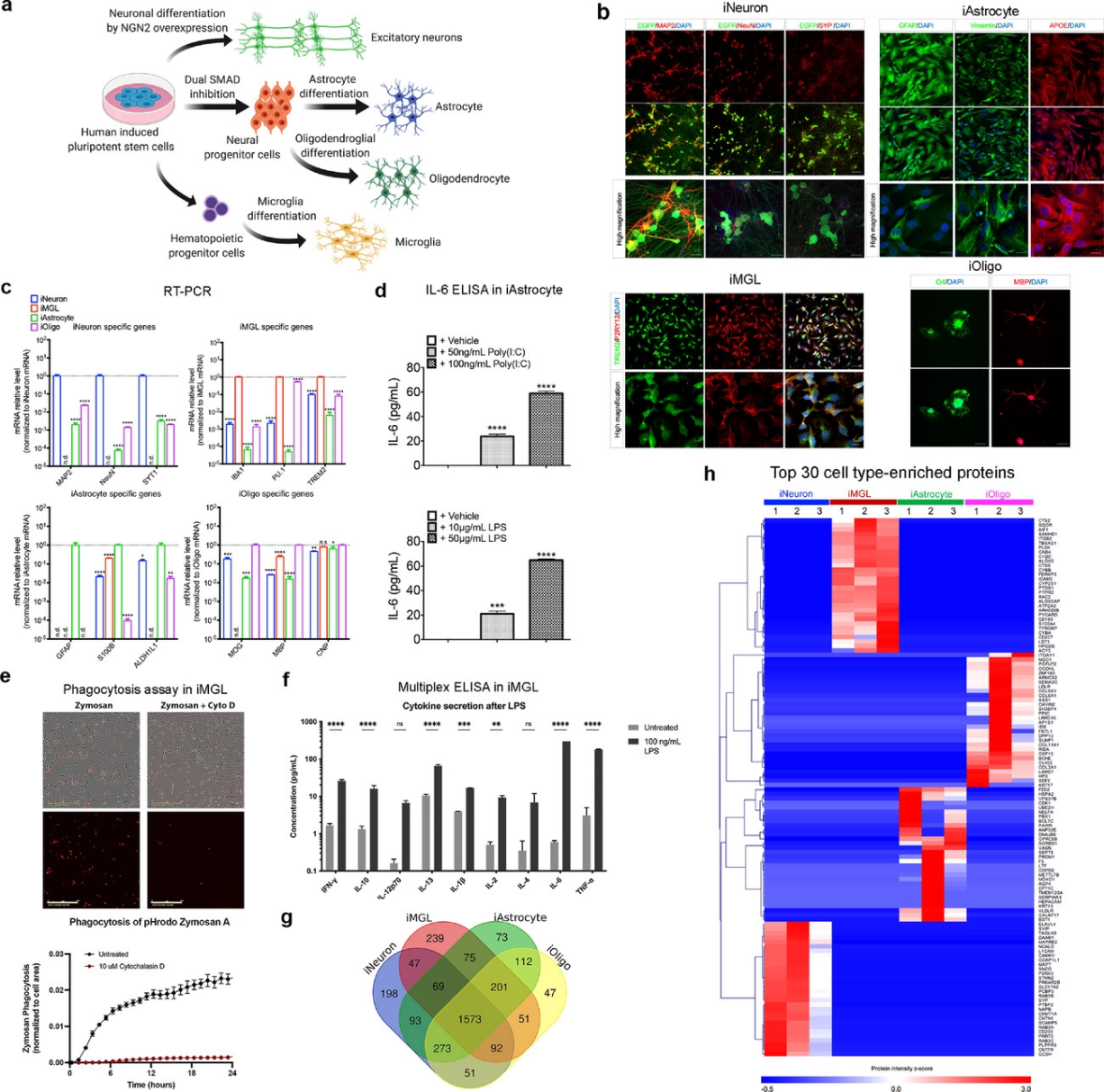
图1 脑细胞类型的分化和表征。
2.从hiPSC衍生的脑细胞中分离和鉴定细胞外囊泡
作者利用分化的四种神经细胞来分离细胞外囊泡(EV)(图2a),通过TEM和NTA分析所得到的EV。纯化的EV在透射电子显微镜下显示出帽形形态(图2b),大多数人脑细胞衍生的EV的预期直径范围为50-150nm,除了iAstrocyte衍生的EV(图2b),iAstrocyte-EV的平均直径为222.0±2.6 nm,显著高于其他神经细胞类型(图2c)。进一步使用labelfree蛋白组学方法分析不同细胞类型的EV蛋白质组成,确定了iNeuron衍生EV (iNeuron-EV)特有的109种蛋白质、iMGL衍生EV(iMGL-EV)特有的197种蛋白质、iAstrocyte特有的378种蛋白质- EV和iOligo-EV独有的117种蛋白质(图2d),并且没有发现非EV蛋白标志物(图2e),证明从hiPSC衍生的脑细胞中分离出的EV质量良好。同时,作者筛选了16个在所有细胞类型特异性EV中均有表达的蛋白(图2f-图2g),包括β-肌动蛋白(ACTB)、甘油醛-3-磷酸脱氢酶(GAPDH)、烯醇化酶1(ENO1)、热休克蛋白(HSPA8)、Ras相关蛋白(RAB7A)、整合素 (ITGB1)、膜联蛋白(ANXA1、2、5、6)、基础免疫球蛋白(BSG)、一类过氧化物酶(PRDX1、2)、前列腺素F2受体负调节因子(PTGFRN)、皮离蛋白(DCD)、CD59。
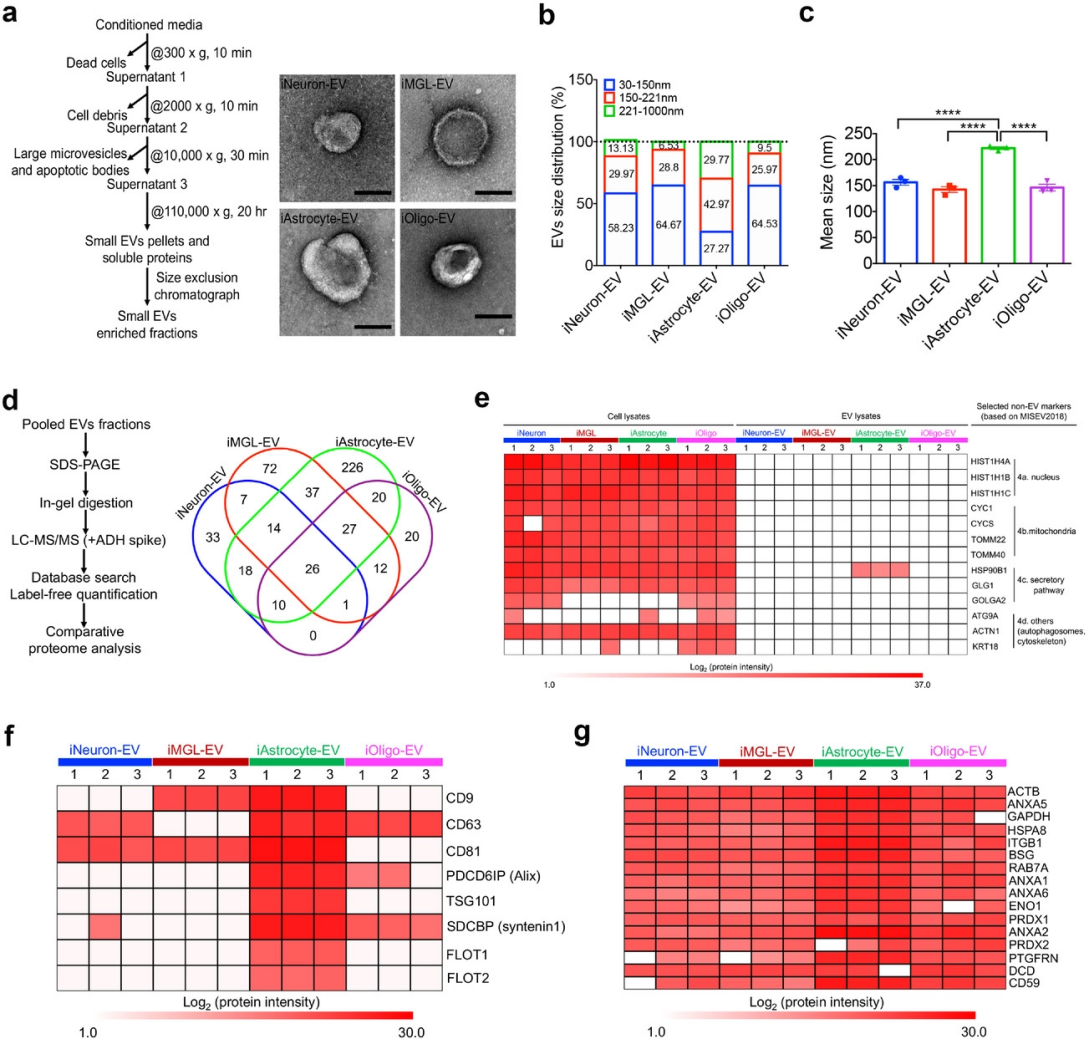
图2 从hiPSC衍生的脑细胞中分离和表征细胞外囊泡。
3.神经细胞类型特异性EV蛋白质组的比较
基于无标记强度的绝对定量(iBAQ)方法比较了不同细胞类型的蛋白质丰度。主成分分析(PCA)对不同细胞类型特异性EV样本具有较好的鉴别能力;EV蛋白质组的所有生物复制根据它们的表达谱形成独立的簇,揭示了EV分离和非标定量蛋白质组学的高重现性(图3a)。此外,Pearson相关系数在生物复制之间较高,而在不同细胞类型之间则低得多(图3b)。以上结果证明了EV出色的生物重现性和潜在的细胞类型特异性蛋白质特征。
在去除非EV污染物后,对495种已鉴定不同细胞类型的EV蛋白进行聚类分析,并确定了细胞类型特异性EV蛋白特征(图3c),进一步进行基因富集分析,包括基因本体生物学过程(GO-BP)和KEGG(图3d)。对于iNeuron-EV,富集的蛋白质主要与离子转运、干扰素-γ介导的信号传导、MAPK级联、神经元投射发育和胰岛素分泌相关。对于iMGL-EV,生物学功能和通路主要与免疫过程有关,包括T细胞受体信号传导、核因子NF-κB介导的信号传导、抗原加工和呈递、免疫反应或自身免疫性疾病。对于iAstrocyte-EVs,富集的蛋白质主要与细胞外基质相关,包括细胞粘附、细胞外基质(ECM)-受体相互作用和整合素介导的信号传导的生物学过程,以及糖酵解、丙酮酸代谢过程、胆固醇稳态、生物合成、氨基酸和碳代谢的代谢通路。最后,iOligo-EV中丰富的生物过程和通路涉及铁离子稳态和溶酶体功能。总之,这些比较分析可能代表了EV中捕获的每种细胞类型所特有的不同细胞功能。
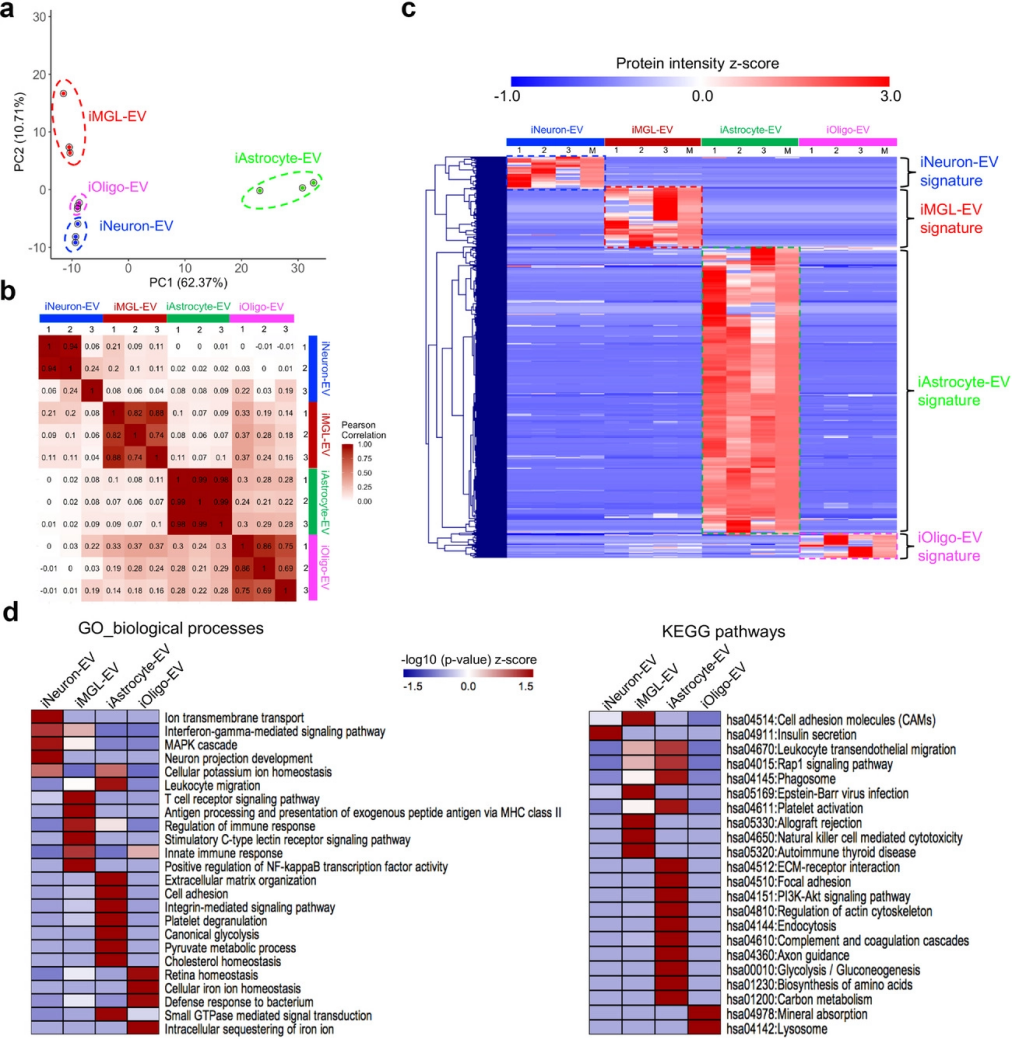
图3 hiPSC衍生的细胞类型特异性EV蛋白质组的比较分析。
4.hiPSC衍生的细胞类型特异性EV蛋白的鉴定
鉴于在不同的hiPSC衍生的神经细胞类型中观察到明显的EV蛋白特征,研究通过筛选特定的特异性蛋白作为人脑EV的细胞类型特异性生物标记物。通过对EV蛋白质组的定量比较和倍数变化比较,初步筛选出合适的细胞类型特异性蛋白(图4a-b),观察到细胞骨架蛋白(MAP1LC3B2、TUBB2A)、突触(VAMP2、STX1B)、能量过程(ATP1A3、ATP1B1)以及其他神经元特异性蛋白(RTN1、NCAM1)是iNeuron-EV特有的特征蛋白。ITGB2、ITGAM/CD11b和LCP1,在iMGL-EV中高表达。对于iAstrocyte-EV,代谢转运蛋白(SLC2A1、SLC1A5)、脂蛋白(APOE、LRP1)、星形胶质细胞特异性细胞表面抗原整合素(ITGA6/CD49f)以及波形蛋白高表达。最后在iOligo-EV中观察到显著富集的蛋白质包括溶酶体蛋白(LAMP2、ACP2)和铁蛋白重链(FTH1)。然后通过蛋白质印迹方法进一步验证特异性蛋白(图4c-4d),最终确定将NCAM1、ATP1A3作为iNeuron-EV的标志物,LCP1作为iMGL-EV的标志物,LRP1、ITGA6、EAAT1作为iAstrocyte-EV的标志物,LAMP2、FTH1和MOG作为iOligo-EV的标志物。
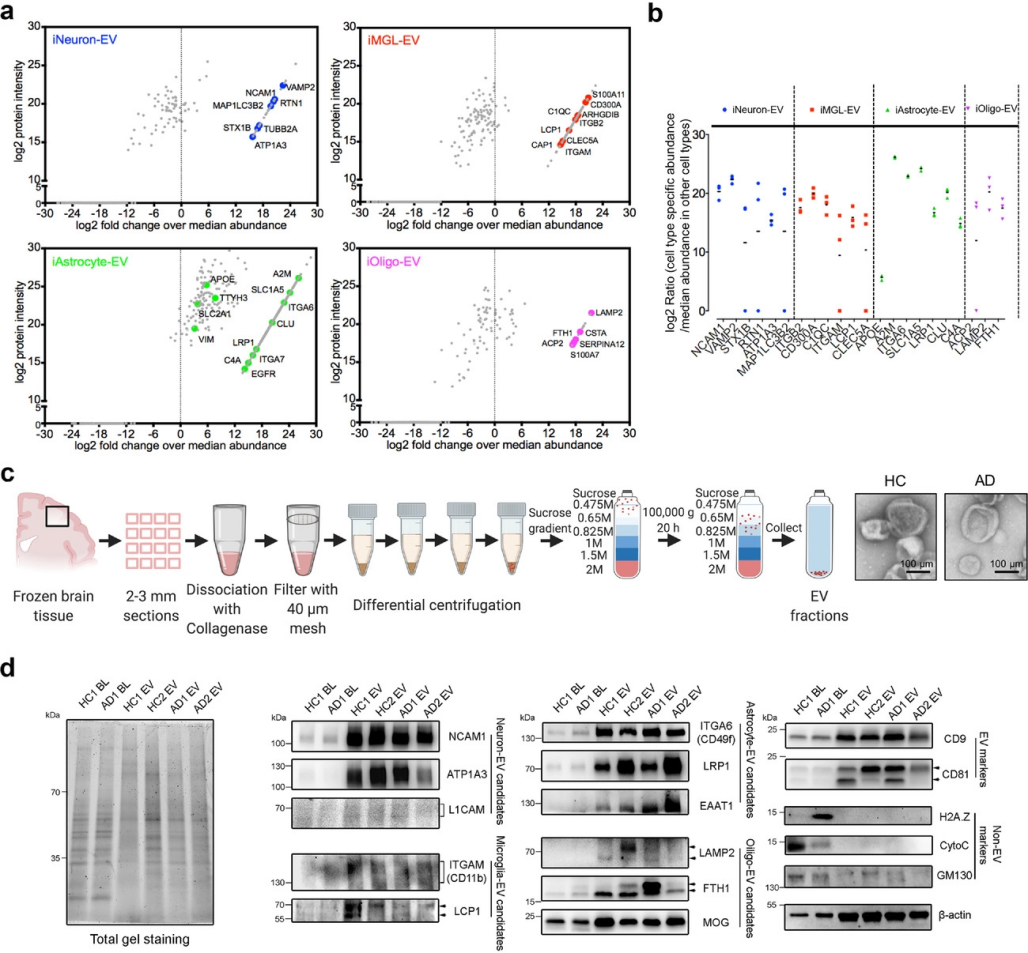
图4 细胞类型特异性EV蛋白的鉴定。
5. 人脑组织衍生EV的蛋白质组学分析
为了加强蛋白质组学发现并探索它们对临床应用的潜在转化,分析了来自30名人脑组织的EV,包括11名健康对照(HC)、8名轻度认知障碍患者(MCI)和11名AD患者(图 5a)。使用TMT标记定量蛋白组学鉴定和量化EV蛋白,实验共鉴定了4286种脑源性EV蛋白。根据蛋白质丰度,PCA显示了三组之间的边际分离(图5b),然后通过单向方差分析和Tukey共鉴定到242个显著改变的EV蛋白。通过对这些显著差异表达蛋白(DEPs)的无监督分层聚类,可以观察到与HC或MCI-EV相比,AD-EV中有130个上调DEPs,而112个DEPs的明显下调(图5c)。GO-BP富集分析表明,AD中上调的DEPs与细胞外基质、白细胞迁移、转运和整合素介导的信号通路有关,而下调的DEPs与DNA损伤识别、蛋白质折叠和Cullin去内基化有关(图5d)。另外,它们在细胞外外泌体的GO-MF分析中都高度表达,进一步证明了AD大脑中EV蛋白质组的显著改变。
通过Tukey事后检验进一步缩小显著性DEPs的范围,共鉴定了42个DEPs,并从三组差异蛋白热图中确定了几种疾病特异性DEPs(图5e)。AD-EV特异性变化包括主要组织相容性II类细胞表面受体(HLA-DRA、HLA-DRB1、4、5)、S100钙结合蛋白(S100A6和S100A10)、上皮膜蛋白3(EMP3)、细胞间粘附分子1(ICAM1)、整合素α5 (ITGA5)和淀粉样前体蛋白(APP)。MCI-EV中参与氧化磷酸化(COX7C、COX7A2、NDUFA4)和 ATP酶 Na+/K+运输家族成员(ATP1B4、ATP5MD、ATP5MG)的DEPs减少,而小型VCP/p97相互作用蛋白(SVIP)增加。此外,一些DEPs在HC、MCI和AD中呈渐进性增加,包括乳粘素(MFGE8)、CD163、S100A11、ANXA1、巨噬细胞甘露糖受体1(MRC1)和细胞色素P450蛋白(CYP4F11)。结果表明,这些疾病特异性的DEPs为区分从HC、MCI和AD大脑中分离出来的EV提供了可能。
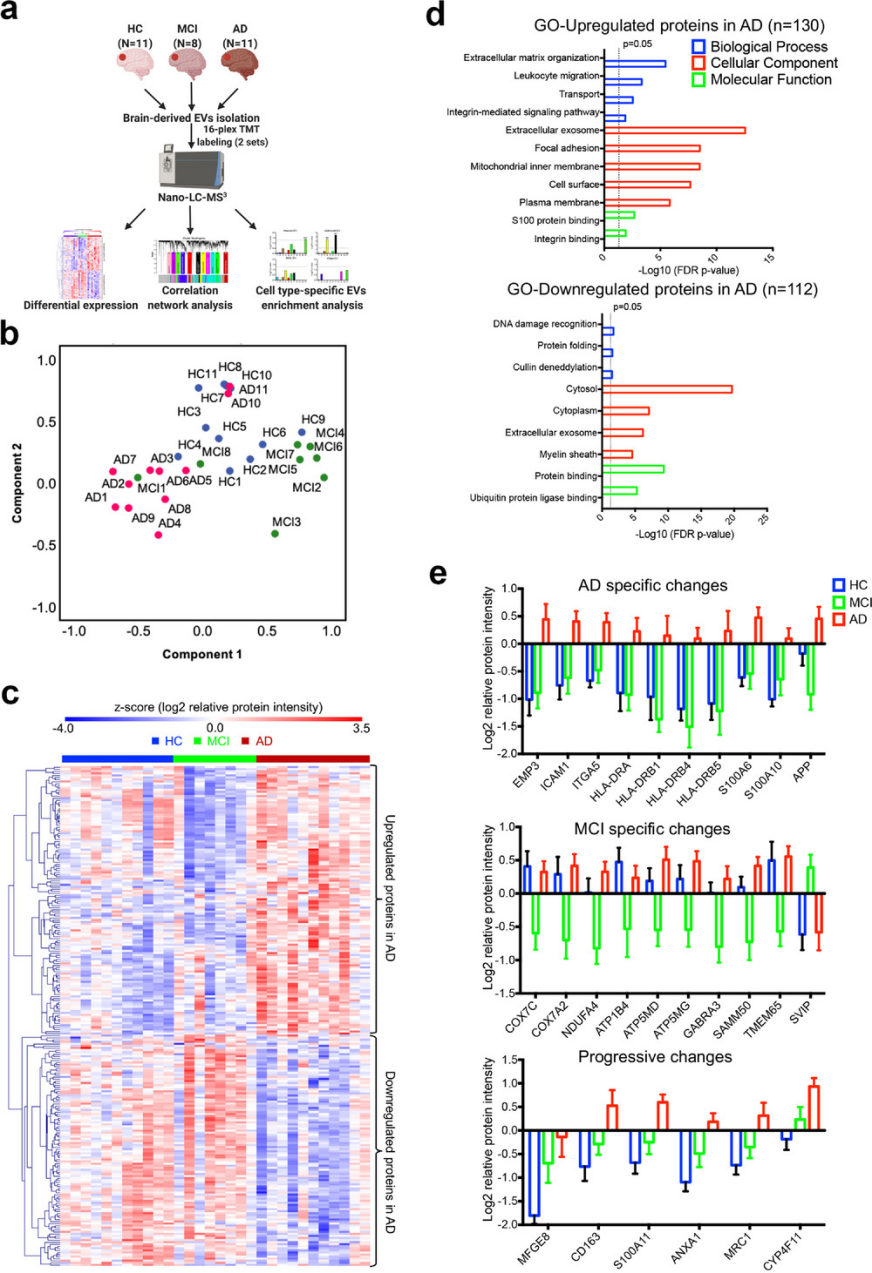
图5 从HC、MCI和AD的大脑中分离出的 EV 的蛋白质组学分析。
6. 细胞类型特异性AD-EV蛋白共表达网络的构建
为了对与疾病表型、特定细胞类型和生物途径相关的蛋白质共表达模块进行分类,作者利用2645个共有蛋白构建了一个AD-EV蛋白质共表达网络,从共表达的蛋白质组中鉴定了11个模块,大小从720个蛋白质的最大模块M1到42个蛋白质的最小模块M11(图6a)。为评估模块与AD病理学的重要性,将模块特征蛋白与AD的神经病学特征相关联,包括Aβ斑块负荷、神经原纤维缠结负荷和CDR评分(临床痴呆评分),确定了与质膜的内在成分相关的M7模块与所有AD特征具有最强的正相关性(图6b)。
作者进一步对细胞类型特异性EV蛋白标志物在每个共表达模块中的富集情况进行分析(图6c),在M7模块中发现了iAstrocyte-EV标志物的显著富集,表明星形胶质细胞衍生的EV具有作为AD生物标志物的潜力,并可能有助于病理发展。此外还通过疾病状态测量了模块特征蛋白值,以确定可能影响MCI到AD变化的EV蛋白网络(图6d),与HC相比,M4、M6和M7模块在MCI中显示出与AD中相同增加或减少趋势,这意味着细胞粘附组装、细胞对氮饥饿的反应和质膜的内在成分出现在AD的临床早期,富含M4和M7的星形胶质细胞衍生的EV可能是AD进展的重要介质。M8、M9和M10模块在 MCI样本中显著变化,表明这些蛋白质网络在认知衰退中的短暂和特异性调节,以及它们在认知功能中的重要性。
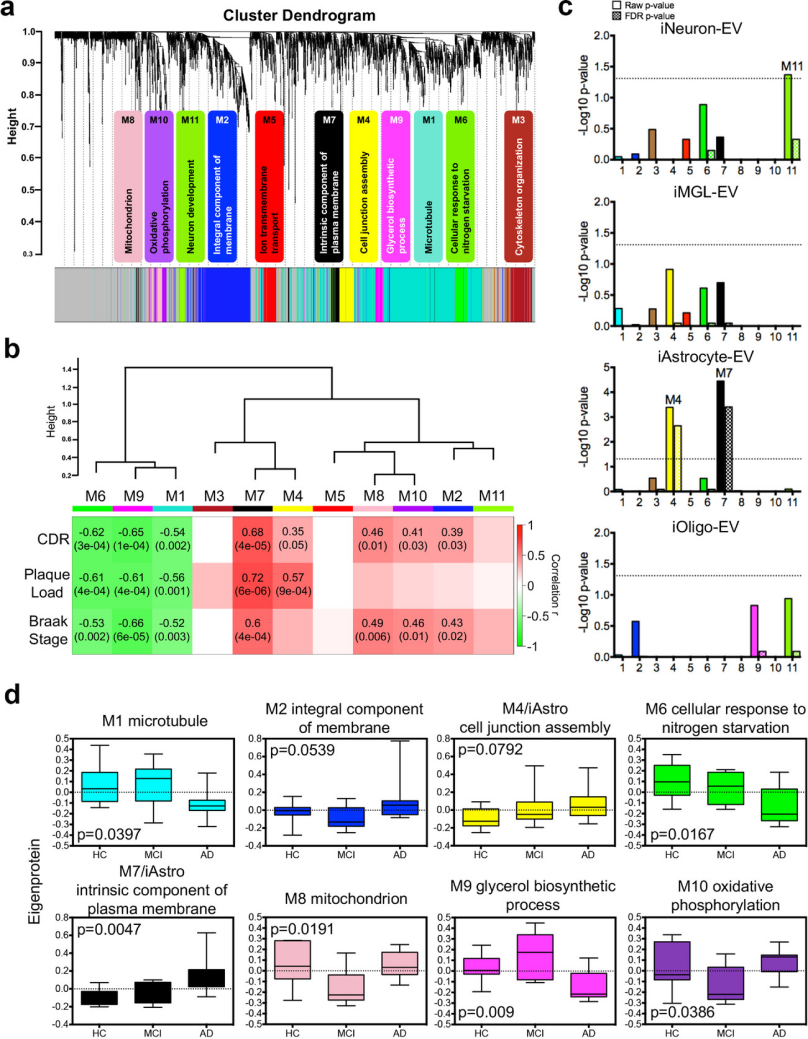
图6 脑源性EV蛋白质组的蛋白质共表达网络的构建与特定基因本体和脑细胞类型相关的模块。
7. M7/星形胶质细胞模块在激活的星形细胞来源的EV标记物中富集,并与AD病理相关
作者进一步研究了M7/星形胶质细胞模块是否与激活的星形胶质细胞衍生EV相关,发现M7和M6模块在活化的星形胶质细胞衍生的EV标记中显示出显著富集(图7a),还观察到 M7模块中激活的星形胶质细胞衍生的EV标记物与前10个中心蛋白密切相互作用,这些蛋白与AD特征的显著相关(图7b)。独创性路径分析鉴定了与内吞作用、整合素信号传导和 NF-κB活化相关的多个重要的经典通路(图7c)。
为了进一步验证来自M7星形胶质细胞模块的EV蛋白是否与AD病理学相关,通过使用针对星形胶质细胞特异性EV标记LRP1和EAAT1的抗体进行免疫沉淀,从脑源性总EV中富集星形胶质细胞特异性 EV(图7e)。免疫沉淀的EV样品中存在新发现的星形胶质细胞标记ITGA6 37和常见的EV标记CD9、EAAT1和LRP1(图7f)。值得注意的是,在免疫沉淀的 EV 样品中检测不到其他细胞类型特异性 EV 蛋白(ATP1A3、LCP1 和 FTH1),以上数据表明,使用针对EAAT1和LRP1的抗体成功地免疫沉淀了来自总脑源性EV的星形胶质细胞源性EV。在用EAAT1将强度标准化后,与对照组相比AD样本中星形胶质细胞特异性 EV 中的 ITGB1 水平显著增加,而ITGA6和CD9的水平没有变化(图7f)。值得注意的是,ITGB1水平也与AD致病标志显著相关(图7g)。研究结果表明M7星形胶质细胞模块内EV蛋白共表达网络在AD发病机制中的起主要作用。此外,已鉴定的M7-EV蛋白(如ITGB1),特别是在星形胶质细胞特异性EV中,可用作潜在的AD生物标志物。
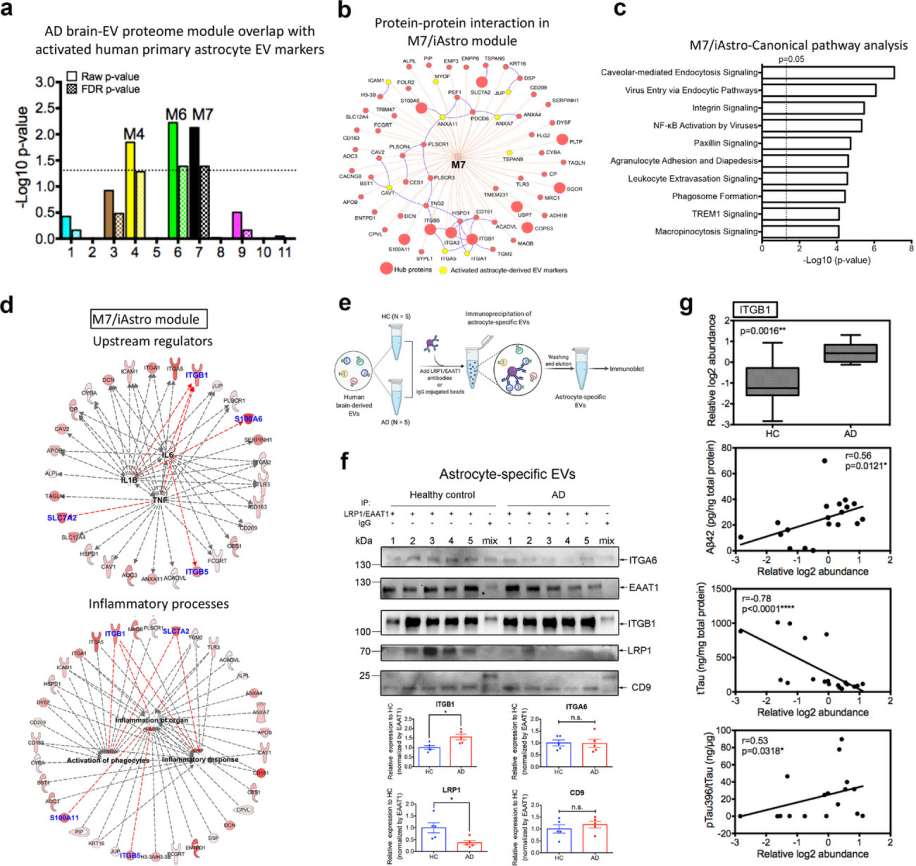
图7 M7模块富含活化的星形胶质细胞衍生的EV标志物并参与炎症过程。

三、结论
文章对从hiPSC衍生的神经细胞和AD脑衍生的EV中分离的细胞类型特异性EV的组合蛋白质组学研究证明了EV分离的细胞类型特异性EV标记物的可用性和特异性,进一步的研究发现星形胶质细胞衍生EV中的ITGB1蛋白可作为潜在的AD生物标志物。这些发现提高了我们对神经退行性疾病中EV生物学的理解,并有望开发出专门针对AD的新型诊断和治疗靶点。
文章链接:
https://doi.org/10.1002/jev2.12183
参考文献:
You Y. Satoshi M. Mark P. J. et al. Human neural cell type-specific extracellular vesicle proteome defines disease-related molecules associated with activated astrocytes in Alzheimer’s disease brain[J]. Journal of Extracellular Vesicles, 2022, 11(1): e12183.
编辑丨Aaliyah
审核丨Tao Li














