本期解读

一、研究背景
胃癌(GC)是威胁全球公共卫生的相关癌症死亡的主要原因,大多数患者诊断时已为晚期,治疗方案有限,预后不良,而胃病变的多阶段变化和早期GC发展的分子特征尚不明确,这限制了胃癌的预防和控制的能力。鉴定与胃癌前病变进展和早期胃癌发展相关的分子特征和生物标志物对于降低全球胃癌负担具有重要的公共卫生意义。

二、研究路线
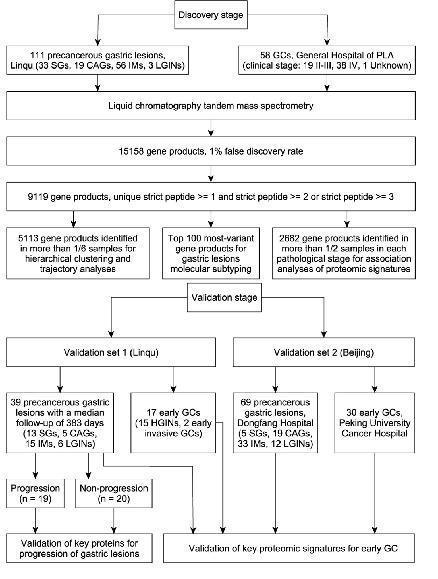
图1 蛋白质组学分析胃癌前病变和胃癌相关特征的技术路线

三、研究结果
1.癌前病变和GC的蛋白质组学分析
基于非标定量(iBAQ)方法,通过LC-MS/MS检测了111名癌前病变患者和58名胃癌患者的胃粘膜组织,共鉴定了15158个基因产物(FDR为1%),其中9119个被认为具有高可靠性。所有样品在组织蛋白质组的定量方面表现出良好的一致性。
2.胃病变过程中的蛋白表达模式
对三个预选定的受试者组进行了无监督的蛋白质聚类分析:轻度胃病变(SG/CAG)、晚期胃病变(IM/LGIN)和胃癌(GC),这揭示了从胃病变到GC的不同特征,而总体差异轻度和晚期胃部病变似乎不太显著(图2)。然后沿着胃病变进展的级联探索了详细的蛋白质表达模式,并提取了6个具有相似轨迹的蛋白质簇(图3),显示了从轻度胃病变、晚期胃病变到GC的蛋白质组学特征的动态变化。
在聚集簇中,cluster-1蛋白在晚期胃病变中高度表达,尤其在生物氧化和细胞氨基酸代谢过程中富集,在人类蛋白质图谱中已注释的肠道特异性蛋白质(MUC2、FABP1、MYO7B、ANXA13和CDH17)在cluster-1中富集。Cluster-2蛋白在碳水化合物途径的消化和代谢中富集,在胃部轻度至晚期病变的受试者中表达下降,然后在GC受试者中急剧下降。已知的胃特异性蛋白,如PGC 、MUC5AC、MUC1、TFF1、TFF2、VSIG1、VSIG2、CTSE、ANXA10 在cluster-2中聚合。相反,随着胃部病变的严重程度,cluster-3蛋白的表达增加,并且经IL-12 刺激(如CA1和SP100)和氧转运(如SLC4A1和PSME2)后在JAK-STAT信号通路中富集。cluster-4中的蛋白质富含囊泡介导的转运(如HPX和IGF2R)和免疫系统通路(如PSMC5和 STAT6)中的细胞因子信号,在胃病变过程中呈稳定变化,但在GC中急剧增加。cluster-5中的蛋白质在含核碱基的小分子代谢过程(例如 APOA1BP和SLC44A2)和羧酸分解代谢过程(如GLUL和ALDH6A1)富集。cluster-6中的蛋白质在平滑肌收缩(如COX5A和CALM1)和巨噬细胞迁移的负调节(如DDT和MIF)通路中富集。簇5和簇6均出现从轻度、晚期胃病变到GC的波动(图3)。
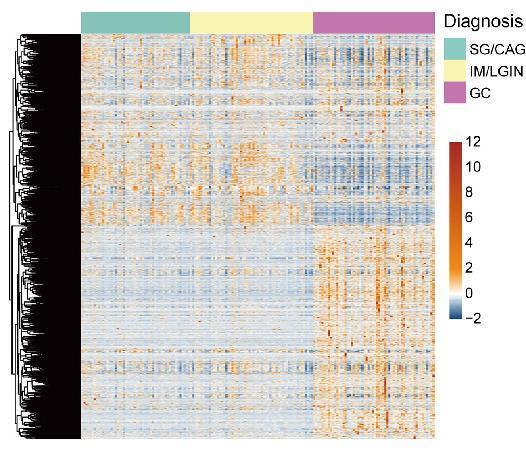
图2 三个预选定受试者组蛋白质谱的层次聚类:轻度胃病变(SG/CAG)、晚期胃病变 (IM/LGIN)和胃癌(GC),每列表示一个受试者,每行表示一种蛋白质。
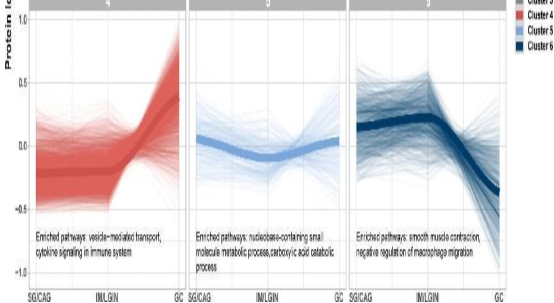
图3 从轻度(SG/CAG)到晚期(IM/LGIN)胃病变再到GC,六个聚集蛋白簇的相似轨迹。CAG: 慢性萎缩性胃炎;GC: 胃癌;IM: 肠化生;LGIN: 低级别上皮内瘤变;SG: 浅表性胃炎。
3.基于蛋白质组学的胃病变分子亚型
此研究进一步探索了超出细胞形态水平的胃病变(SG、CAG、IM或 LGIN)的分子相似性和异质性。基于在超过3/4的胃病变受试者中检测到的前100个变异最大的蛋白质,通过NMF算法推导出胃病变的4个分子亚型(S1-S4)。分子亚型与病理诊断的严重程度之间存在显著相关性,图4a为亚型特异性蛋白质热图,S1亚型代表蛋白质组定义的轻度胃病变,S4代表最严重的胃病变。蛋白质组亚型的分布与幽门螺杆菌感染无关。与亚型S1相比,在其他亚型中高表达的蛋白质在凋亡过程中富集。S4亚型表现出上皮谱系标志物(EPCAM、KRT20、FABP1)的高表达,而S2表现出单核细胞标志物(S100A8、S100A9)的高表达,S3表现出成纤维细胞(COL3A1)的高表达,表明非癌性胃病变可能产生了自己的“微环境”,随着上皮细胞变化,组织微环境的持续改变,包括巨噬细胞和成纤维细胞,也可能参与GC 的致癌作用。
4.与胃病变进展和早期GC相关的关键个体蛋白
研究探索了关键的单个蛋白质,以寻找潜在生物标志物的线索。在FDR-q<0.05(逻辑回归分析)时,没有发现与晚期胃病变(IM/LGIN)风险相关的蛋白质。相比之下,1201种蛋白质在发现阶段与侵袭性GC风险显著相关,并集中验证了217种早期GC风险,包括104个正相关蛋白和113个负相关蛋白(图4b、表1)。
通过对验证集中受试者的前瞻性随访,考察了上述217种蛋白质与胃病变进展风险之间的关联。APOA1BP、PGC、HPX 和DDT四种蛋白与胃病变进展风险和随访终点发生IM或更严重胃病变的风险显著相关(P< 0.05,逻辑回归分析)。其中,胃蛋白酶原C(PGC)是已知具有消化功能的胃蛋白酶C的前体,此前已证明其对GC的诊断和预后预测具有潜在的重要性。HPX与早期GC和胃病变进展呈正相关,而APOA1BP、PGC和DDT呈负相关(图4b-4c和表1)。这四种突出显示的蛋白质分别聚集在cluster-2(PGC),-4(HPX),-5(APOA1BP)和-6(DDT)中。此外还考察了随访期间蛋白质表达的动态变化,发现仅在随访期间进展受试者中APOA1BP和PGC的表达显著降低。由于样本量有限,我们没有发现基线和随访终点之间HPX和DDT的显著差异,但在进展受试者的终点仍存在HPX表达增加和DDT表达减少的趋势(图4d)。APOA1BP、PGC、HPX和DDT与早期GC的关联在北京集中验证得到了进一步验证(表1)。将两个验证集合并后,DDT、PGC和APOA1BP显示与早期GC显著负相关,而HPX显示显著正相关。
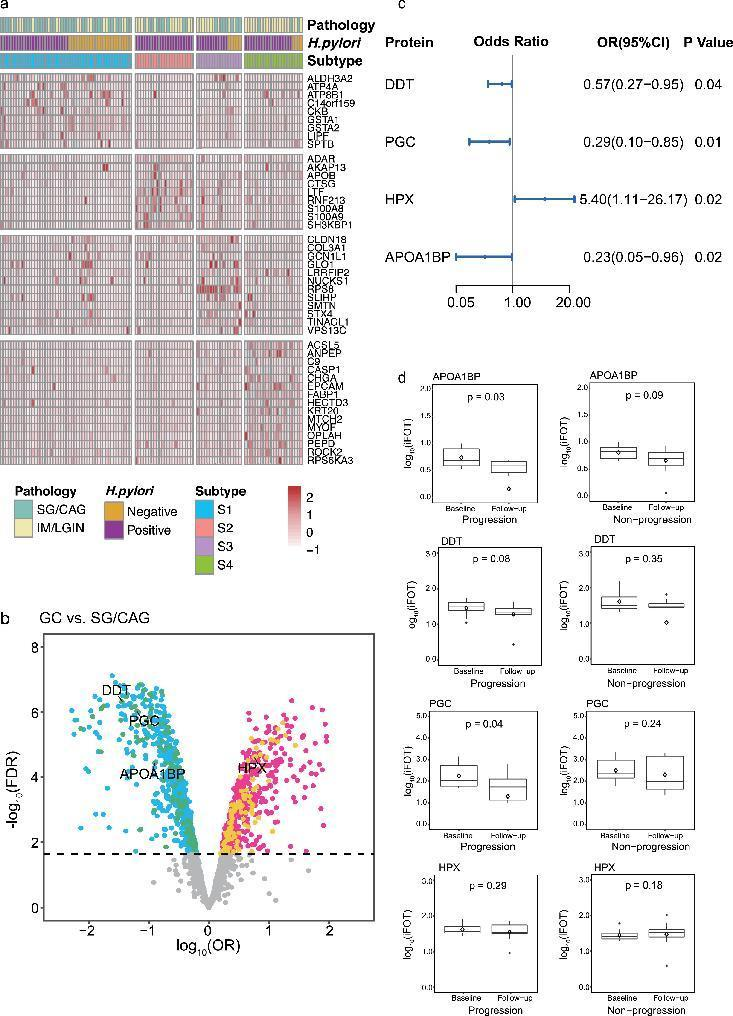
图4 癌前病变的蛋白质组学亚型以及与GC和胃病变进展相关的蛋白质组学特征。(a) 通过无监督亚型特异性蛋白质热图; (b) 与GC显著相关的蛋白质。在发现阶段与GC显著相关的蛋白质(FDR-q<0.05,逻辑回归分析)以粉红色(阳性)和蓝色(负相关)点表示,与早期GC验证的蛋白质以黄色(阳性)和绿色(负相关)点表示,标记了在前瞻性随访中与胃病变进展显著相关的四种蛋白质; (c) 基于前瞻性随访的四种蛋白与胃病变进展风险的关系; (d) 随访期间进展(n=10)和未进展(n=11)受试者在基线和随访终点的四种蛋白的表达。
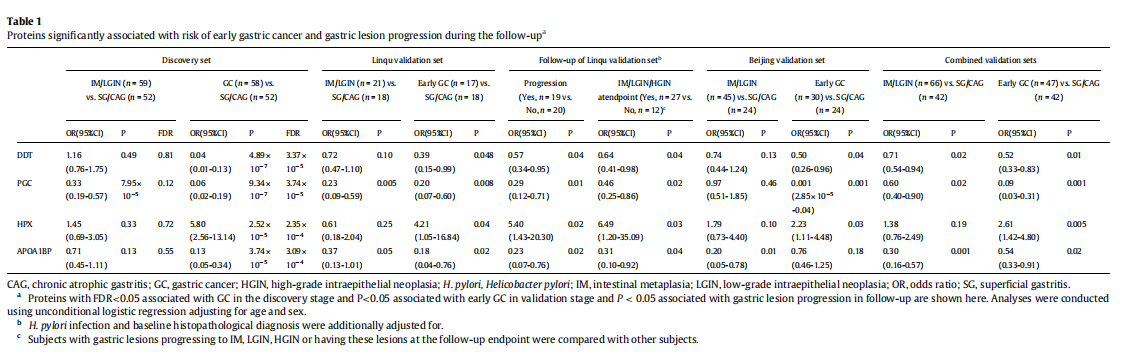
5.胃病变进展风险评分及预测模型的构建
结合在前瞻性分析中选出的四种关键蛋白质,得出了风险评分模型:Risk score =﹣1.485×APOA1BP﹣1.231× PGC﹢1.686 ×HPX﹣0.565× DDT。根据验证队列,风险评分与胃病变进展风险独立相关,风险评分每增加一个标准差,OR为4.09(95% CI:1.48-11.27,逻辑回归分析)(图5a)。此外,通过整合蛋白质组学特征,还构建了胃病变进展的机器学习预测模型(图5b)。为了帮助将研究结果转化为临床和预防环境,作者开发了基于65种FFPE组织的四种关键蛋白质的IHC分析(图5c),所有四种蛋白质主要在细胞质中染色。APOA1BP、DDT和PGC在HGIN和侵袭性GC中的表达显著降低,而HPX在HGIN和侵袭性GC中的表达显著增加,与蛋白质组学分析的结果一致。
图5 验证胃病变进展的蛋白质组学特征和风险预测模型。(a) 胃病变进展的风险评分模型;(b) 胃病变进展的机器学习预测模型;(c) 四种关键蛋白质的IHC分析。

四、结论
研究展示了不同阶段胃病变和胃癌的蛋白质组学,并根据受试者的前瞻性随访发现了四种具有不同进展潜力的胃病变蛋白质组学亚型,揭示了胃病变超出细胞形态的分子异质性。APOA1BP、PGC、HPX和DDT四种蛋白质被证实与胃病变进展和早期胃癌的风险相关,整合蛋白质组学特征得到的风险预测模型显著提高了预测胃病变进展的能力,促进了在GC预防和临床环境中的研究结果的转化。
文章链接:
https://doi.org/10.1016/j.ebiom.2021.103714
参考文献:
(1) Repetto O, De Re V, Giuffrida P, et al. Proteomics signature of autoimmune atrophic gastritis: towards a link with gastric cancer. Gastric Cancer 2021;24(3):666–79.
(2) Ning P, Sun L, Dong N, et al. PGC-MG7 combination could be used as a followup panel for monitoring dynamical progression of gastric precancerous diseases.Chin J Cancer Res 2020;32(1):89–95.
(3) Thrift AP, HB El-Serag. Burden of gastric cancer. Clin Gastroenterol Hepatol 2020;18(3):534–42.
编辑丨Aaliyah
审核丨Tao Li














