本期解读

一、研究背景
SARS-CoV-2是COVID-19的病原体,对人类健康构成极大的威胁。感染SARS-CoV-2通常会引起轻微症状,但在部分患者中出现过度炎症性免疫反应,导致急性呼吸窘迫综合征等严重后果。SARS-CoV-2通过其S蛋白与宿主细胞表面的血管紧张素转换酶2 (ACE2) 结合,进入呼吸道,然后被丝氨酸蛋白酶(TMPRSS2)切割。而鼻咽是SARS-CoV-2暴露的主要部位,鼻咽的宿主蛋白质组学研究有助于了解发病机制和发现药物靶点的线索。使用鼻咽拭子(NP拭子)对包括鼻咽粘膜在内的上呼吸道进行采样,这是COVID-19诊断测试的标准采样。虽然已有使用NP拭子检测病毒的质谱研究,但NP拭子的宿主蛋白质组学分析仍落后。

二、研究路线
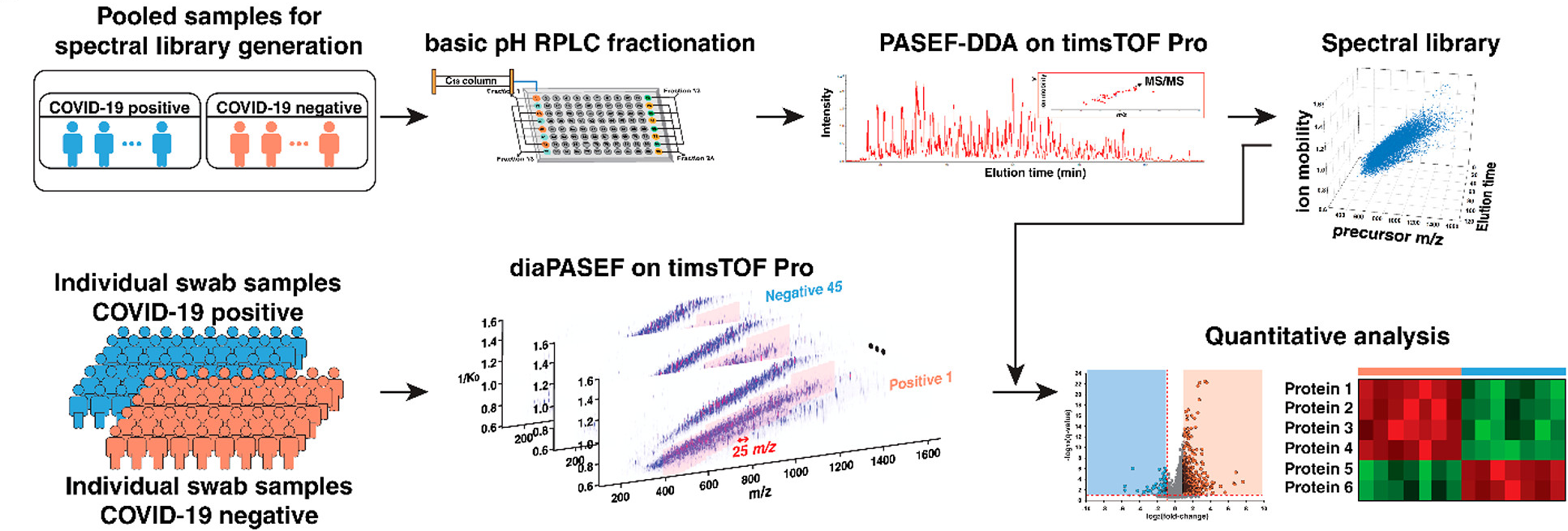
图1 基于DIA的蛋白质组分析的整体工作流程。在timsTOF Pro质谱仪上使用diaPASEF模式处理和分析鼻咽拭子样本。从合并样本中获取PASEF-DDA数据,整理成库并分析。

三、研究结果
1. 综合定量蛋白质组学
DDA方法的一个主要缺点是缺乏可重复测量,这主要是因为MS/MS分析期间前体离子采样的随机性。相比之下DIA方法确保了所有前体离子在任何预定的隔离窗口内碎裂,从而显着提高蛋白质组检测的重现性。作者设计了支持与DIA耦合的PASEF模式的质谱研究,通过注射培养Jurkat细胞的肽消化物来评估在PASEF模式下运行的DDA和DIA的性能,然后分析所获得的PASEF-DDA数据。从三次DDA重复实验中鉴定出4747种蛋白质,重复检测到2721种蛋白质(57%),相反,在三个DIA实验中的每一个中都鉴定出相同的4490种(94%)蛋白质(图2A)。diaPASEF实验的相关性大于PASEF-DDA实验中观察到的相关性,证实了可重复性是DIA的主要优势,对于大规模分析来说是非常理想的(图2B)。

图2 (A) PASEF-DDA和diaPASEF三次实验中蛋白质组数量的条形图;(B) PASEF-DDA和diaPASEF三次实验的蛋白质丰度相关性。
2.利用PASEF-DDA生成鼻咽综合蛋白质目录
由分级样品的PASEF-DDA数据可知,实验共识别出对应7723个蛋白质组的102392个肽,整理为光谱库后再将其与之前的鼻咽蛋白质组学研究进行比较来评估光谱库的全面性(图3A)。结果表明此项研究涵盖了前人研究中检测到的大多数分子,此外还发现了5110个前人研究遗漏的基因,证实本研究提供了迄今为止用NP拭子收集鼻咽蛋白质最广泛的蛋白质目录。细胞亚型分析图(图3B)证实鼻咽拭子样本含有免疫细胞和上皮细胞的异质混合物,免疫细胞亚型(包括B淋巴母细胞和NK细胞)富含免疫细胞特异性标志物,如CD2、CD14、CD38和颗粒酶B,上皮细胞与上皮细胞特异性标志物包括CDH1和CLDN3。由图3C可知母离子质量范围为300至1700 m/z,离子迁移率范围为0.6至1.6 V s cm–2。接下来通过基于强度的绝对量化(iBAQ)值评估蛋白质组学的深度(图3D)。在neXtProt数据库中搜索相同的数据,确定了7243个蛋白质组及其iBAQ值,蛋白质丰度跨越了6个数量级的动态范围,表达最低的蛋白质是淋巴细胞抗原75(LY75),而最丰富的蛋白质是免疫球蛋白κ恒定链(IGKC)。此外还检测出几种表达良好的鼻咽特异性蛋白,例如BPIFA1/2和AMY1A。
研究进一步将鉴定的蛋白与neXtProt数据库中的“缺失蛋白质”列表匹配。值得注意的是,五种已鉴定的蛋白质(GOLGA8F、CROCC2、HSP90AA4P、PMS2P11和WDR49)被标记为缺失蛋白质。其中,WDR49属于蛋白质存在PE2(仅在转录水平的证据)类别,而其余四种蛋白质属于PE5(不确定或可疑)类别。由图3E的蛋白质CROCC2和肽LEDTILSPTASR的MS/MS谱图和动态谱图可得到进一步的验证。
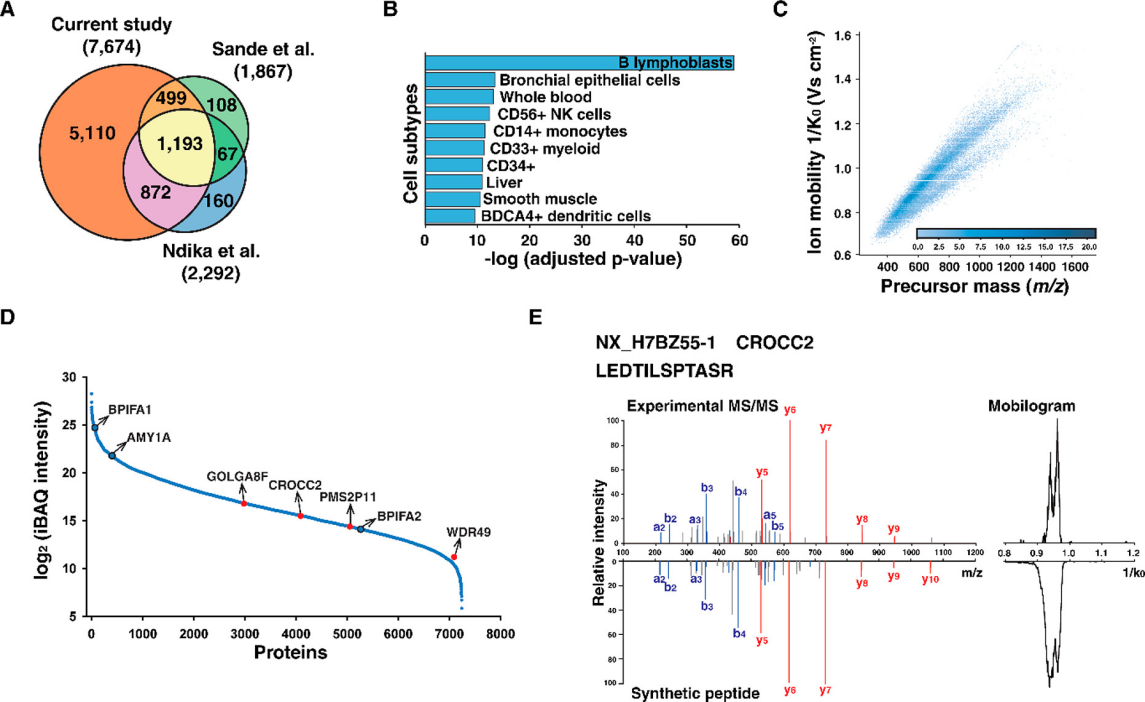
图3 鼻咽蛋白质组目录的生成。(A)鼻咽蛋白质组与之前NP拭子样本的蛋白质组学研究的比较。(B)PASEF-DDA 实验中细胞蛋白质亚型的鉴定。(C)谱库中包含的102392种肽段的前体质量密度分布和离子迁移率。(D)已鉴定蛋白质的iBAQ强度分布。鼻咽中表达的蛋白质标记为黑色,缺失的蛋白质标记为红色。(E)缺失蛋白CROCC2的实验和合成肽LEDTILSPTASR的MS/MS光谱和动态图。
3.单个鼻咽拭子的diaPASEF定量分析
通过使用25 m/z的隔离窗口以diaPASEF模式注射相同量的肽(即1μg),对单个SARS-CoV-2阳性和阴性NP拭子样本进行蛋白质组的无偏测量。由图4A可知实验共检测到79703个肽段,对应5023个蛋白质组,平均每个样品检测到3387个蛋白质组。在SARS-CoV-2阳性样本鉴定到的4943种蛋白质中,577种蛋白质被上调,46种蛋白质被下调(|fold-change|>2和调整后的p值<0.05)(图4B)。如预期所料,在SARS-CoV-2阳性受试者中IFN基因上调,作者将上调的蛋白质与IFN调节基因数据库匹配,得到了432种与IFN调节基因相关的蛋白质,包括IFIT1、IFIT2、IFIT3、IFIT5、ISG15、ISG20、MX1、MX2、OAS1和OAS3。
通过独创性途径分析(IPA)根据其功能和亚细胞定位对差异蛋白进行分类(图4C)。分析表明,差异蛋白为来自各种细胞室(主要为细胞质)的141种酶、46种转录调节剂和40种激酶。许多激酶在阳性样本中上调,包括TBK1、CMPK2和TAOK3。图4D为DAVID对上调蛋白质的生物过程进行了基于基因本体的富集分析。分析证明了与病毒感染的先天免疫反应相关蛋白质的显着富集,包括I型IFN和IFN-γ介导的信号通路,虽然富集在FDR>0.1时不显着,但可观察到几种与凋亡过程负调控相关的蛋白质(SERPINB10、BNIP3L、BCL2L1和HMGA2)。
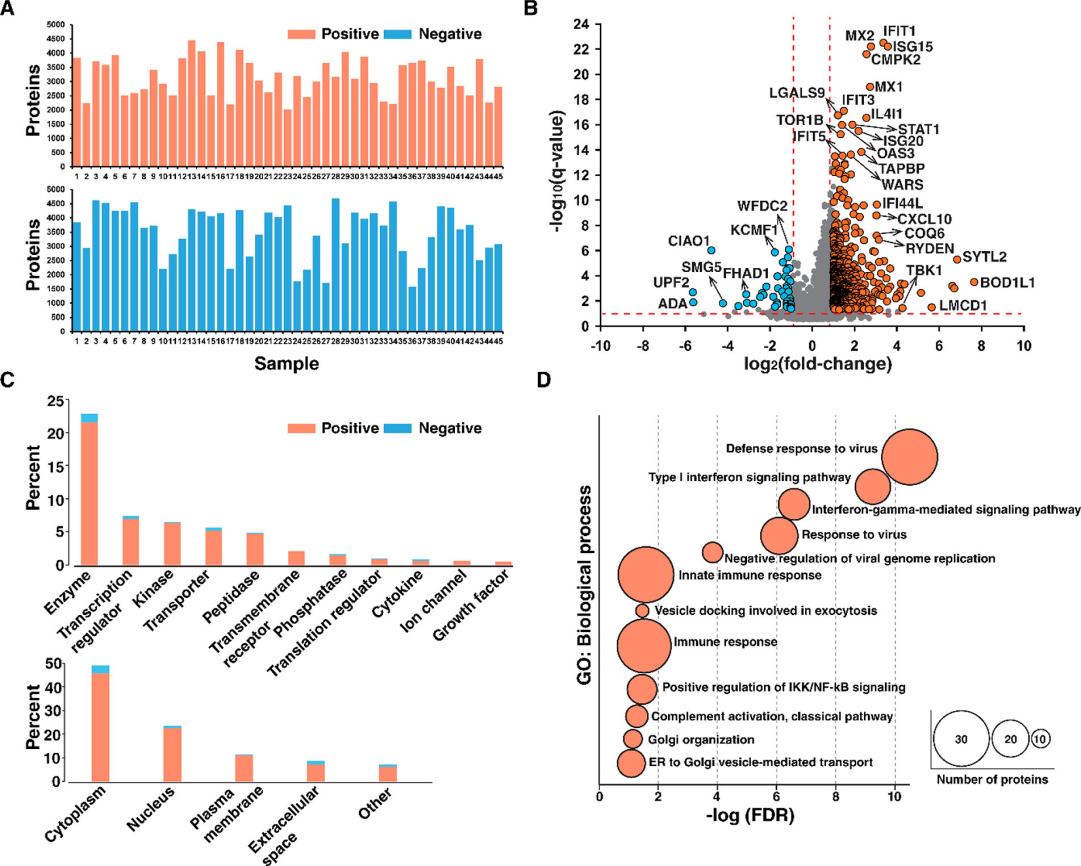
图4 diaPASEF的定量分析。(A)利用diaPASEF对45个SARS-CoV-2阳性和45个阴性样本的实验分析中获得的蛋白质数量的条形图。(B)描述阳性和阴性样品之间蛋白质表达变化的火山图。(C)条形图显示差异表达蛋白质的分子类型和亚细胞定位。(D)上调蛋白质的基因本体论分析。根据DAVID的错误发现率(FDR<0.05)显示生物过程。圆圈的大小表示与每个生物过程相关的蛋白质数量。
4. 先天免疫反应以及病毒复制的特征
先天性IFN反应途径是抵御病毒感染的第一道防线之一。如图5A所示,病毒识别触发caspase激活和募集结构域(CARD)与线粒体抗病毒衔接蛋白(MAVS)相互作用,随后MAVS启动下游信号传导,激活核因子kB (NF-κB)和TANK结合激酶1(TBK1),这些蛋白质磷酸化干扰素调节因子3 (IRF-3),导致核转位和I型干扰素(IFN-I)的表达。分泌的IFN-I激活Janus激酶1(JAK1)和酪氨酸激酶2(TYK2),磷酸化信号传感器和转录激活蛋白(STAT1/2)。磷酸化的STAT1和STAT2形成异二聚体,与干扰素调节因子9(IRF9)结合形成ISGF3,ISGF3进入细胞核并使数百个ISG表达。作者进一步根据功能不同对鉴定的ISG进行分类,并将研究中鉴定的蛋白质与先前表征的628个ISG匹配(图5B)。研究发现鉴定的65种蛋白质在特征ISG列表中,其中35个ISG被归类为IFN介质/抗病毒效应子。此外,PARP9、PARP12和PARP14也属于35种IFN介质/抗病毒效应子中的一种。
除抗病毒免疫反应外,图4D的功能富集分析还揭示了与病毒复制相关的其他生物学过程,例如参与胞吐作用的囊泡对接内质网(ER)到高尔基体囊泡介导的转运。SARS-CoV-2遵循病毒感染的一般机制——将RNA输送到细胞中,然后复制并随后从细胞中释放出来。在这种情况下,预计胞吐作用途径将在SARS-CoV-2阳性受试者中占主导地位。作者发现七种上调蛋白(VPS18/45、STXBP1、PLEK、EXOC4、RAB8B和SYTL2)与胞吐作用中的囊泡对接过程相关。同样,ER到高尔基体囊泡介导的转运和高尔基体组织过程的表达也发生了改变,因为病毒复制和组装利用了ER到高尔基体隔室的结构支持,其中发生了病毒生命周期的不同步骤,包括复制和组装。
由于大多数已鉴定的与ER或高尔基体相关的蛋白质尚未在SARS-CoV-2研究中报道,因此作者构建了每个过程的蛋白质-蛋白质相互作用 (PPI) 网络(图5C),以分析在每个过程中起关键作用的分子。蛋白质LMAN1、COG8和FOLR1证明是在ER/Golgi相关过程中具有更高相互作用的分子。LMAN1也称为ERGIC53,是一种货物受体,与早期胞吐作用中的糖蛋白转运有关,且LMAN1对病毒生命周期至关重要,若LMAN1缺失会产生非感染性病毒颗粒。COG8是寡聚高尔基体(COG)复合体的一种,并参与细胞内膜运输。
将差异蛋白与报道过的SARS-CoV-2相互作用组进行比较,进一步评估差异蛋白是否与病毒蛋白相互作用。图5D可观察到有24种上调蛋白质已被证实是与SARS-CoV-2相互作用的蛋白质。其中,MRPS27、NUP54/214、BRD2/4、RIPK1、NUP98和DNMT1——可抑制这些蛋白质的药物已获批准生产,可以使用基于SARS-CoV-2感染的模型系统进行进一步研究。这是首次证明这些蛋白质在SARS-CoV-2感染的临床样本中表达水平升高,需要进一步的功能分析才能将它们作为任何治疗策略的潜在靶标。
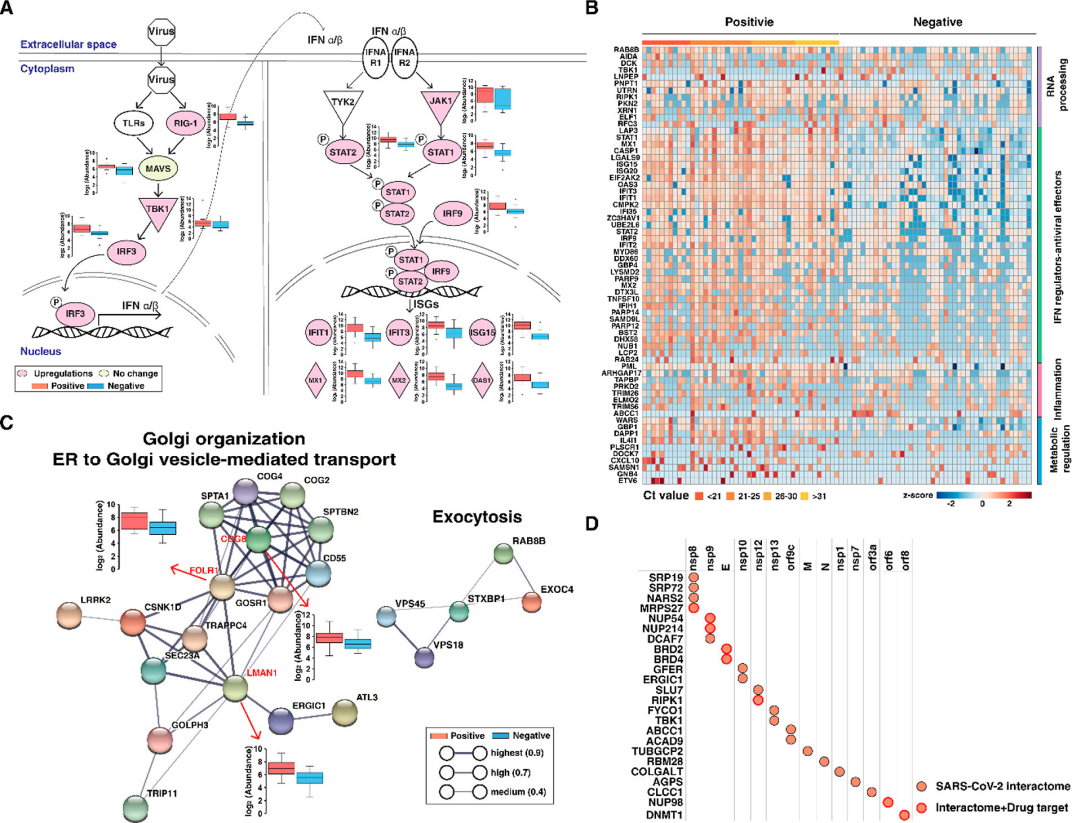
图5 SARS-CoV-2阳性受试者中上调蛋白的功能分析。(A)阳性样本中升高的代表性典型途径。描述了RIG-I样受体(RLR)和Toll样受体(TLR)介导的IFN-α/β产生和下游干扰素信号通路。显示了所选蛋白质的箱线图。(B) 90个样本中64个ISG的热图,根据其RNA过程、IFN调节剂-抗病毒效应器、炎症和代谢调节的功能进行分类。(C)与高尔基体组织、ER到高尔基体囊泡介导的转运和胞吐作用相关的分子的蛋白质-蛋白质相互作用。显示了蛋白质 COG8、FOLR1、LMAN1的箱线图。(D)已知与SARS-CoV-2相互作用的上调蛋白质。

四、结论
研究证明使用diaPASEF方法对临床样本进行全面的蛋白质组学分析可以帮助破译宿主对SARS-CoV-2感染的反应。数据揭示了SARS-CoV-2阳性受试者中几种生物过程的激活,包括先天免疫反应(IFN信号通路),以及病毒复制(胞吐作用和ER/高尔基体转运)。
文章链接:
https://doi.org/10.1021/acs.jproteome.1c00506
参考文献:
(1) Gallo, O.; Locatello, L. G.; Mazzoni, A.; Novelli, L.; Annunziato, F. The central role of the nasal microenvironment in the transmission, modulation, and clinical progression of SARS-CoV-2 infection. Mucosal Immunol. 2021, 14 (2), 305−316.
(2) Hewitt, R. J.; Lloyd, C. M. Regulation of immune responses by the airway epithelial cell landscape. Nat. Rev. Immunol. 2021, 21 (6), 347−362.
(3) Hoffmann, M.; Kleine-Weber, H.; Schroeder, S.; Kruger, N.; Herrler, T.; Erichsen, S.; Schiergens, T. S.; Herrler, G.; Wu, N. H.; Nitsche, A.; Muller, M. A.; Drosten, C.; Pohlmann, S. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell 2020, 181 (2), 271−280.
编辑丨Aaliyah
审核丨Tao Li














