本期解读
一、研究背景
自第一个SARS-CoV-2序列出现以来,世界各地的实验室已将超过39万条完整的基因组序列列入该名单。尽管有大量可用序列,但仍不清楚病毒突变的速度,以及在日益严重的大流行背景下突变是否影响其毒性。此外,关于该病毒的临床蛋白质组学的信息也很少。直到最近,只有少数蛋白质,主要包括结构蛋白N和S,已经从临床拭子中被鉴定出来。此外,还需要从临床样本中进行宿主蛋白质组研究,以填补了解宿主对病毒感染反应的空白。
二、研究路线
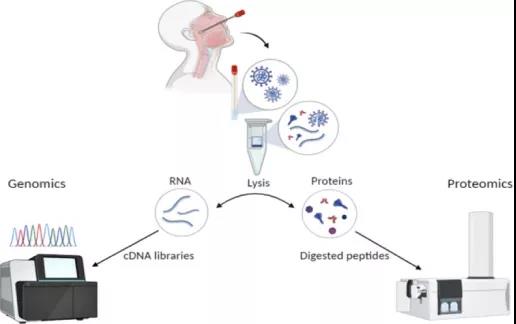
图1 SARS-CoV-2阳性患者的基因组学和蛋白质组学分析
三、研究结果
1. SARS-CoV-2的基因组序列
从3个鼻咽拭子中提取的SARS-CoV-2 RNA经RT-PCR检测呈阳性,被转化为cDNA并进行NGS处理,分析检索了三个样本的全基因组序列。这三个分离株与参考基因组Wuhan-Hu-1的比对显示了在所有样本中SNPs的普遍性(图2)。样本1、2和3分别显示了11、16和19个SNPs。分离株共发现27个变异,其中4个为所有人共有变异,11个为样本2和3独有变异。在所有三个分离株中观察到的四种常见的突变都是c.241C>T,c.3037C>T,c.14408C>T和c.23403A>G。研究共发现了9个属于最常见突变类型的突变,其中6个(c.241C>T,c.3037C>T,c.14408C>T,c.23403A>G,c.25563G>T和c.28881G>A)在所有大洲都很常见,c.26735C>T和C.28854C>T是针对亚洲分离株的,C.18877C>T在美国和亚洲的分离株中均有发现。由于这些点突变而导致的氨基酸替换如图2的下面板所示。在27个突变中,有25个突变位于编码区,它们产生了14个同义氨基酸替换和11个错义氨基酸替换。这11个错义突变中有3个可能具有很高的影响,因为它们以带电荷替代不带电荷的氨基酸,或者反之亦然,因此可能会影响蛋白质的结构和功能,包括刺突糖蛋白中的p.D614G,ORF3a中的p.Q57H,和核衣壳中的p.G204R。
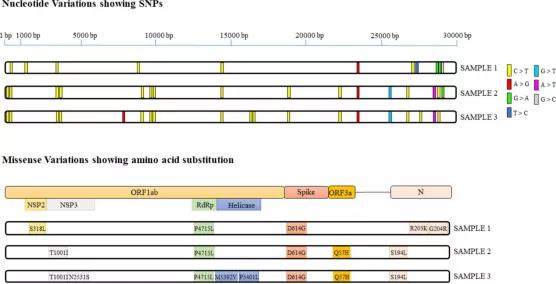
图2 印度分离株 SARS-CoV-2 基因组的变异分析。该图的上图表示 SARS-CoV-2 班加罗尔分离株基因组序列中的核苷酸变异 (SNPs) 与Wuhan-Hu-1分离株完整基因组序列的对比。下面板指示错义突变相对于Wuhan-Hu-1,SARS-CoV-2 分离株的位置。
2.SARS-CoV-2的临床蛋白质组学
利用错误发现率(FDR)≤1%的MS/MS识别出41种与13种不同病毒蛋白匹配的独特肽段,多为ORF1ab多蛋白。如所示图3,研究检测到8个与核衣壳蛋白匹配的肽段;7个与NSP3匹配;6个与外切核糖核酸酶匹配;4个与2'- O-甲基转移酶匹配;RdRp(NSP12)和核糖核酸内切酶各3个;NSP2、解旋酶和蛋白质9b各2个;NSP8、NSP10、刺突糖蛋白和蛋白3a各有1个肽匹配。在50%的样品中检测到肽 ITEHSWNADLYK(2'-O-甲基转移酶)。样品12显示了最大数量的已鉴定蛋白质(六种归因于六种不同的肽)。在66.6%的样品中检测到2'-O-甲基转移酶蛋白的多肽段。所有RT-PCR阳性样本均显示存在SARS-CoV-2蛋白。

图3 SARS-CoV-2的临床蛋白质组学。肽图为从12名COVID-19患者的临床鼻咽拭子中鉴定的SARS-CoV-2肽段;以黑色突出显示的单元格代表该样本中检测到的肽;肽的序列以及匹配的蛋白质列在左侧;样品鉴定的总肽显示在底部;样品编号1-12按检测到的总肽的升序排列。
3.宿主感染SARS-CoV-2的反应
图4A为宿主蛋白的维恩图。我们鉴定出441个蛋白质存在于阳性样本中是唯一的,246个只存在于阴性样本中,158个是两组共同的。将阳性样本的蛋白质组中独特的蛋白质分类为GO terms和通路,以表征病毒感染时宿主蛋白的动态。图4B根据统计显着性显示了前30个GO terms的点图。我们发现中性粒细胞介导的免疫反应,包括脱颗粒和中性粒细胞激活通路,在阳性样本中更高(35个基因计数),这些通路中涉及的丰富蛋白质在阳性样本中富集。此外,还观察到大量参与细胞对氧化应激和有毒物质的反应和代谢途径的蛋白质,例如核苷/核糖核苷三磷酸代谢过程、NAD和NADH代谢过程、氨基酸代谢和糖酵解过程。除此之外,研究还观察到参与RNA加工机制的蛋白质数量的增加,包括调节RNA/mRNA的稳定性、剪接和对Cajal小体的定位。在宿主免疫应答中,在阳性样本中也发现了参与白细胞介素12和7介导的信号通路的蛋白。图4D显示了在阳性样本中发现的独特蛋白的通路的丰富图谱。研究结果表明,SARS-CoV-2与所有病毒一样,在生物学、分子和细胞方面操纵宿主的生存。
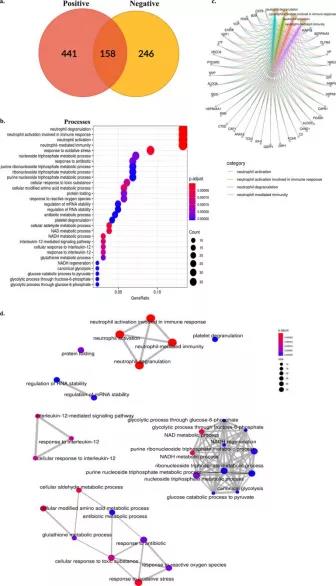
图4 SARS-CoV-2感染细胞的临床蛋白质组和蛋白质动力学特征。阳性样本的蛋白质组(鼻咽拭子)。(a)COVID-19阳性和COVID-19阴性宿主蛋白质组的维恩图;(b)阳性样品中鉴定的独特蛋白质的通路分析。该图的Y轴代表以基因计数从高到低顺序排列的通路。(c)类别网络图,将基因和生物过程的联系描述为显示参与其中的基因的前四个富集通路的网络。(d)富集图通过将富集项的重叠基因集连接到网络中来说明功能模块的集群。Emap代表COVID-19阳性临床样本的独特蛋白质组的整体网络和通路。
4. 病毒蛋白和宿主反应之间的相关性
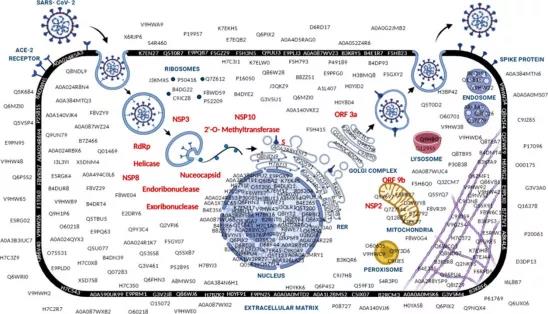
图5 SARS-CoV-2 和宿主细胞蛋白质组概述。该图描绘了研究中鉴定的SARS-CoV-2和宿主上皮细胞蛋白质组。在囊泡内化后,冠状病毒RNA会经历一系列复制并转化为病毒蛋白。病毒蛋白以红色文本表示,阳性样本中鉴定的宿主蛋白以黑色显示。像刺突糖蛋白这样的病毒结构蛋白通过ER进行折叠和运输。单独组装在细胞质中的核衣壳形式(RNA和N蛋白)进一步与ER-Golgi中间隔室中的结构蛋白结合,形成完整的病毒粒子,组装的病毒粒子通过胞吐作用离开受感染的细胞并继续传播。
四、结论
研究提供了SARS-CoV-2的蛋白质基因组分析,证实了印度分离株的高突变率,以及病毒蛋白(Orf9b)在宿主中的表达细胞,抑制了宿主的先天免疫反应,参与中性粒细胞介导的免疫反应的蛋白质的富集指向宿主和病原体之间的串扰。研究强调了MS作为一种特异性和敏感诊断工具的潜力,并为未来的研究奠定了基础,进一步的研究结合患者的严重程度细节可以帮助预测病毒感染的预后。
文章链接:
https://dx.doi.org/10.1021/acs.jproteome.0c00808
参考文献:
(1) Hussein, H. A.; Hassan, R. Y. A.; Chino, M.; Febbraio, F. Point of-Care Diagnostics of COVID-19: From Current Work to Future Perspectives. Sensors 2020, 20, 4289.
(2) (2) Durrant, J. D.; Kochanek, S. E.; Casalino, L.; Ieong, P. U.; Dommer, A. C.; Amaro, R. E. Mesoscale All-Atom Influenza Virus Simulations Suggest New Substrate Binding Mechanism. ACS Cent. Sci. 2020, 6, 189−196.
(3) Gouveia, D.; Miotello, G.; Gallais, F.; Gaillard, J.-C.; Debroas, S.; Bellanger, L.; Lavigne, J.-P.; Sotto, A.; Grenga, L.; Pible, O.; Armengaud, J. Proteotyping SARS-CoV-2 Virus from Nasopharyngeal Swabs: A Proof-of-Concept Focused on a 3 Min Mass Spectrometry Window. J. Proteome Res. 2020, 19, 4407−4416.
编辑丨Aaliyah
排版丨Stacey Chiu
审核丨Tao Li














