研究背景
心力衰竭是工业化国家发病率和死亡率的主要原因,其特征是心肌收缩力功能受损和心输出量降低。在细胞水平上,有几个因素与心力衰竭的发展有关,包括钙处理缺陷、神经激素失衡和肌节(肌原纤维的基本单位)功能衰退等。增加心肌丝对钙的敏感性以及降低作用力产生能力(Fmax)与心力衰竭之间的联系已被很好地阐明,但其中的分子机制尚未被完全揭示。
研究结果
1.人DCM心肌细胞对肌节收缩功能和肌丝蛋白周转的影响
以往的研究已表明,心力衰竭患者心肌收缩力下降与肌节功能障碍有关。作者通过DCM和NF(正常人皮肤成纤维细胞)样品的皮肤肌细胞证明了肌丝Fmax在DCM中显著降低(图1a-b);在DCM中,EC50(引发半最大力所需的钙浓度)也降低,表明肌丝钙敏感性增加(图1c)。通过蛋白质印迹评估来自DCM和NF组织的富含肌丝部分的泛素化以确定肌节蛋白周转是否受损,发现DCM肌丝上的泛素化显著增加,提示疾病中出现错折叠的肌节蛋白(图1d-e)。通过共聚焦显微镜对人DCM心肌细胞进行泛素染色和蛋白聚集标记寡聚体A11的染色来确定这些泛素化蛋白质是否嵌入肌节本身,结果显示,A11呈弥漫性点状定位,没有明显的肌节模式;然而,泛素定位于横纹型,并在代表肌节A带的厚而规则重复条带中富集(图1f)。表明在肌丝部分中鉴定的泛素化蛋白质在很大程度上结合到肌节中,而不是蛋白质聚集物的成分,进一步表明了DCM中周转不充分的主要蛋白质是那些直接参与张力产生的蛋白质。作者还通过其他实验证明了仅蛋白质错误折叠就足以造成显著的功能损害。
此外,泛素化肽富集的蛋白质组学(图1g)分析提供了心力衰竭中肌丝泛素的特征,并鉴定了几种周转受损的蛋白质。在DCM中泛素化增加最多的包括肌球蛋白轻链-2、结蛋白、肌红蛋白-2、α-放线蛋白-2和肌钙蛋白α-1,且它们的泛素化明显高于NF(图1h–n)。这些数据表明,肌节蛋白周转在DCM中被破坏,导致更多的错折叠蛋白被整合到肌层肌节。
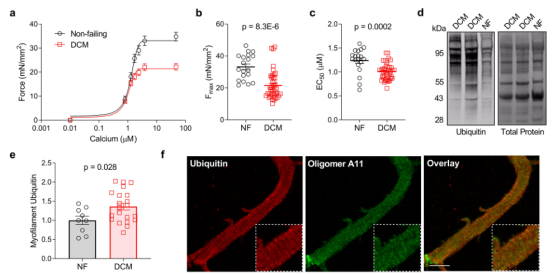
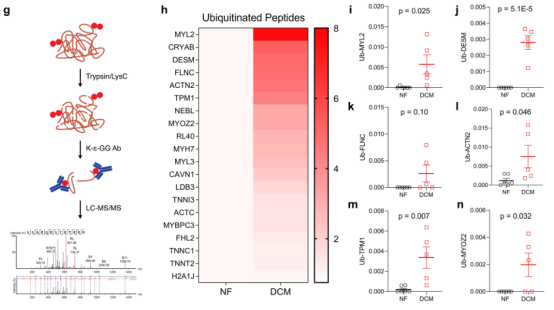
图1 人DCM的特点是肌丝功能降低和肌节蛋白周转受损
2.共伴侣蛋白BAG3在DCM中的肌丝表达减少与Fmax相关
BAG3介导的成年心肌细胞肌节维持的机制知之甚少。使用蛋白质印迹法评估人左心室样本肌丝蛋白部分中BAG3的表达,发现DCM患者中的BAG3水平显著降低(图2a-b),且Fmax与BAG3表达呈正相关,其中BAG3表达降低的样本显示出明显较低的Fmax(图2c),而BAG3水平和钙敏感性之间没有关联(图2d)。为了证实BAG3表达减少和肌节功能障碍之间的关系,采用心肌细胞限制性杂合子BAG3表达(BAG3+/-)的小鼠模型(小鼠在8周龄时被发现有进行性左室功能障碍)和使用6周龄小鼠捕捉BAG3单倍体功能不全对肌丝功能的早期影响。结果显示,6周时,与野生型相比,小鼠显示出约20%的肌丝BAG3减少,与人DCM的减少相当,并且显著增加了肌丝蛋白泛素化(图2e–h)。BAG3种系KO小鼠3周时发现的广泛的肌节细胞结构异常,这个时间点在BAG3+/-小鼠中没有观察到(图2i)。使用对来自BAG3+/-和WT小鼠的皮肤肌细胞的力钙实验评估肌丝功能,发现来自BAG3+/-小鼠的心肌细胞Fmax降低,但钙敏感性没有变化(图2j-l)。这些数据表明BAG3对于肌节的最佳收缩功能和维持肌节蛋白沉积是必需的。此外,尽管肌节形态正常,但由于BAG3单倍化引起的肌节功能障碍仍会出现,这表明受损的肌节蛋白质周转,而不是结构混乱,可能是导致收缩功能障碍并最终导致心力衰竭的最初损伤。即泛素化蛋白仍整合在肌节中,并诱导功能障碍,但结构不一定是混乱的。
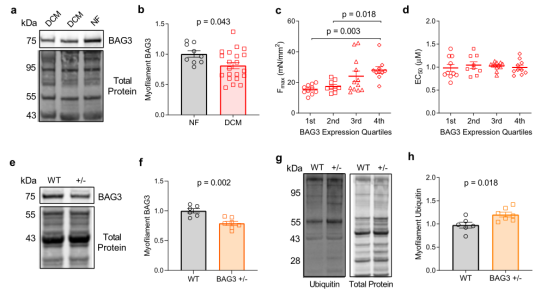
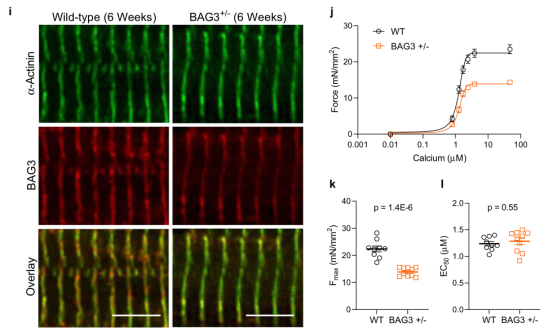
图2 肌节BAG3在DCM中的表达降低,并与肌丝Fmax降低相关
3.伴侣辅助的选择性自噬(CASA)复合物定位于肌节Z盘,并在蛋白毒性应激反应中上调
利用免疫沉淀和质谱技术研究了人左心室肌丝中BAG 3的相互作用研究BAG3对肌节功能发挥作用的潜在机制。人左心室心肌细胞的免疫荧光显微镜观察结果显示,BAG3、HSP70、HSP 80和CHIP均定位于肌节Z-盘(图3a,b)。蛋白质印迹法证实了这种定位是人整个左心室、可溶性和肌丝部分CASA成员(图3c),并用共免疫沉淀法证实了它们之间的联系(图3d,e)。这些数据证实CASA复合物存在于人的心脏肌节中。
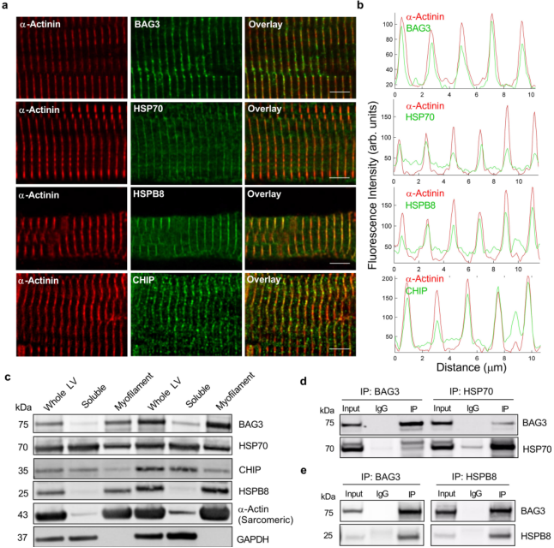
图3 CASA复合物定位于心肌细胞的肌节Z-盘
进一步的研究表明,MG132(蛋白酶体抑制剂)处理引起肌丝部分中BAG3、HSP70、HSPB8和CHIP表达的显著上调,表明CASA响应蛋白毒性应激定位于肌节(图4a–g)。DMSO和MG132处理的NRVMs(新生大鼠心室肌细胞)的共聚焦成像进一步证实了这一发现,显示BAG3对Z-盘的定位响应于MG132而增加(图4h–k)。
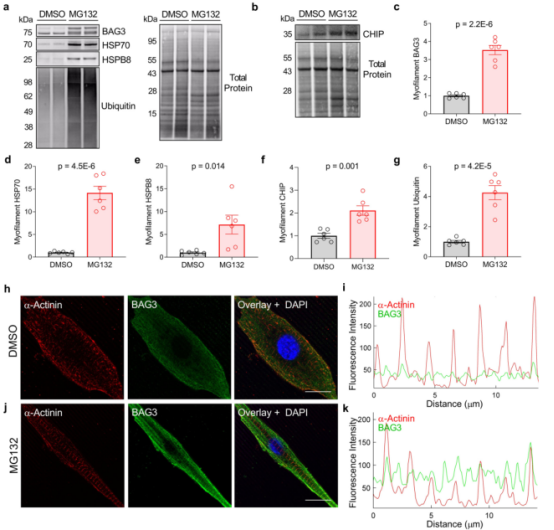
图4 CASA复合物针对蛋白毒性应激的肌节细胞
4.HSPB8和CHIP显示BAG3与肌丝的相关性
使用心肌细胞特异性杂合子和纯合子BAG3缺失的小鼠为模型,发现在部分和完全没有BAG3的情况下,HSPB8和CHIP的肌丝水平降低(图5a–d),而BAG 3的降低并不影响肌丝HSP 70的表达,表示其对肌节细胞的靶向作用机制不同。进一步深入研究HSPB8和CHIP表达水平是否显示出与人BAG3相似的关系,发现与小鼠一样,HSP 70没有显示BAG3依赖于肌丝的定位(图5e-f)。然而,BAG3表达最低的患者肌丝HSPB8水平显著降低(图5g,h),肌丝CHIP表达在低BAG3表达者中没有显著降低(图5i,j)。
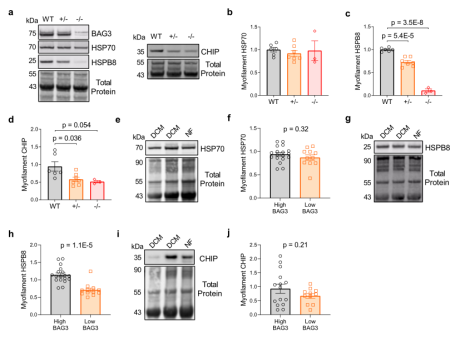
图5
5.八种肌节蛋白被鉴定为BAG3/ CASA介导周转的候选蛋白
鉴定了52种蛋白质,包括三个主要的CASA成员和49个潜在的蛋白质,它们包含在每种蛋白质的相互作用组中(图6a-b),这些潜在的CASA蛋白质主要是肌节成分,其中大部分在细肌丝中起作用(图6b)。进一步的研究证实了丝蛋白-C是人心脏中一种BAG3介导周转的蛋白(图6c-m)。
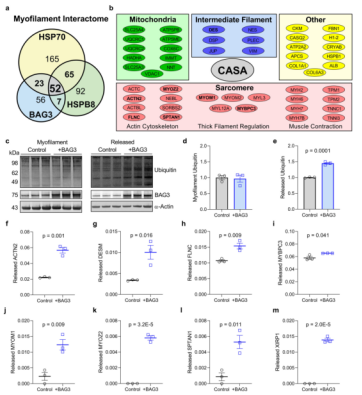
图6 (a) 免疫沉淀蛋白自下向上质谱鉴定BAG 3、HSP 70和HSPB 8肌丝间的定量Venn图;(b) 列出在每个CASA复合体肌丝相互作用组中鉴定的49个共有蛋白;(c) 针对肌丝泛素和肌丝释放的泛素化蛋白的蛋白质印迹,以响应BAG3表达的增加;(d,e) 肌丝(d)和释放(e)泛素的定量密度测定,标准蛋白为α-actin;(f-m) 质谱鉴定的八种肌节蛋白的光谱计数分析表明,随着BAG3表达的增加,释放的蛋白部分增加。
6. BAG3基因治疗心力衰竭恢复心肌丝Fmax和CASA蛋白周转
用force-calcium实验评估梗死边缘区皮肤肌细胞的肌丝功能。与人DCM一样,HF组小鼠心肌细胞Fmax显著降低,然而,在接受rAAV9/BAG3的HF小鼠中,Fmax被完全挽救(图7a,b),但未观察到肌丝钙敏感性的变化,推测可能是由于处在疾病研究进展的相对早期阶段(图7c)。通过评估CASA成员在肌丝部分的表达,发现HSP 70、HSPB 8和CHIP水平在HF小鼠肌丝上的表达均增加(图7d-k)。这些结果表明,在心力衰竭的早期阶段,复合物对蛋白毒性应激反应的肌丝靶向没有受到阻碍,而在心力衰竭的末期(人类数据),BAG3/CASA的应激反应变得失调。BAG 3基因治疗改善了CASA清除问题,使CASA的表达恢复到Sham水平并支持回复周转(图7d–k)。
此外,肌丝水平的自噬泛素受体P62/SQSTM1,一种自噬的必需衔接蛋白,介导泛素化蛋白对自噬体的靶向作用,在HF小鼠中也增加,并通过BAG3基因治疗恢复到基线(图7j),进一步表明清除恢复。最后,通过蛋白质印迹评估了三组之间的肌丝蛋白泛素化以确定BAG3基因治疗对肌节蛋白稳态的影响。发现在HF小鼠中肌丝蛋白泛素化显著增加,正如在人DCM中所鉴定的,表明蛋白周转受损(图7l-m)。然而,在接受4周BAG3基因治疗的HF小鼠中,肌丝泛素化显著减少(图7l-m)。研究结果支持了心力衰竭中增加BAG3表达通过恢复肌节蛋白周转来挽救肌丝Fmax的机制,其中旧的/错折叠蛋白质被CASA从结构中去除,从而允许新合成的蛋白质被整合。
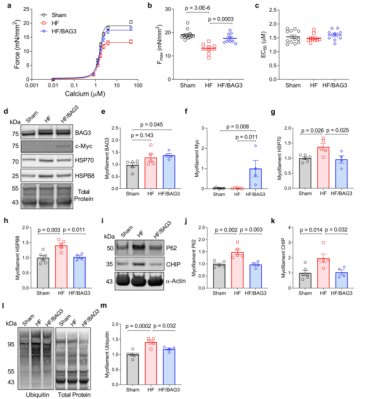
图7
结论:
BAG3介导的肌节蛋白降解减少是肌丝收缩功能下降的主要原因,BAG 3是维持心肌细胞肌节蛋白稳态和最佳张力生成所必需的,表明BAG 3基因治疗心力衰竭的潜在疗效包括通过恢复肌丝蛋白的周转来改善肌丝功能。














