研究背景
泛素化是一种可逆的、高度通用的翻译后修饰(PTM ),涉及几乎所有的细胞过程。利用针对泛素衍生的diGly残留物的抗体结合质谱(MS)的富集策略已使泛素信号通路的大规模研究成为可能。但到目前为止,尚未探索数据独立采集 (DIA) 在单次运行分析中的灵敏度和数据完整性方面的能力。
研究手段
1. 对两个人类细胞系(HEK293和U2OS)进行碱性反向色谱(bRP)分析,以获得用于在单次DIA分析中有效提取diGly肽的全面、深入的光谱库。
2. 通过优化DIA窗口和测试碎片扫描分辨率参数,对DIA方法的设置进行评估。
3. 利用DIA和DDA方法分别对diGly样品进行蛋白质组学分析,比较两种方法获得的结果的准确性。
4. 利用DIA和DDA两种方法分析TNF信号通路的泛素化修饰组学,比较两者量化的泛素化位点以及通过diGly分析揭示TNF调控的蛋白质的泛素化。
5. 基于蛋白质组和泛素化修饰组学方法揭示昼夜节律是否受泛素化调控。
研究结果
1. DIA定量能够在单次实验中实现深入的diGly蛋白质组覆盖
在MG 132处理的HEK 293和U2OS细胞系以及未处理的U2OS细胞系中分别鉴定出超过67,000、53,000和6000个不同的diGly肽(图1b)。在获得的89,650个diGly位点中,对应于93,684个独特的diGly肽,其中43,338个在至少两个文库中被检测到(图1c)。根据Phosphosite-Plus数据库得知不同的PTMs可以作用于相同的位点。研究结果有助于识别潜在的PTM串扰位点,这是蛋白质功能调节的一个重要水平。
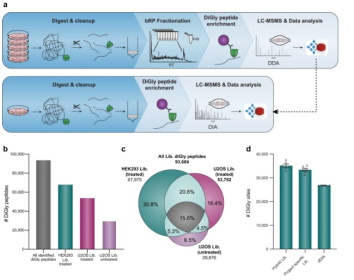
图1 用于DIA鉴定的深度diGly蛋白质组学。(a)用于深入构建diGly肽库的实验工作流程(上图)和基于单次运行数据独立采集(DIA)的工作流程(下图); (b) 三个不同光谱库中鉴定的diGly肽的数量(MG132处理的HEK293文库—绿色,MG132处理的U2OS文库—紫色,U2OS文库—浅紫色,所有diGly肽—灰色); (c) 针对不同文库共同和唯一鉴定的diGly肽
为了实现在单次diGly实验中获得最佳性能,对DIA方法的设置进行评估。首先优化了DIA窗口宽度,其次测试了不同的窗口号和碎片扫描分辨率设置。结果表明,具有相对高的30,000 MS2分辨率和46个前体分离窗口的方法表现最好。此外,最佳抗体和肽输入组合被确定为1/8的抗diGly抗体小瓶(31.25 g)从1 mg肽材料中富集。使用优化过的于DIA的工作流程,研究者们在MG132处理的HEK293样品的单次测量中发现了33,409,605个不同的diGly位点,即使不使用任何库,对六个单次运行的搜索也识别了26,780±59个diGly位点。而通过将DDA库与直接DIA搜索合并生成的混合光谱库在同一样本中得到了35,111±682个diGly位点(图1d)。这些数字表明了以单次运行的形式实现了将diGly肽的鉴定加倍。
2.DIA提高diGly蛋白质组定量的准确性
为了评价整个基于DIA的diGly工作流程的重复性,使用MG 132处理HEK 293细胞,并进行了三种独立的diGly肽富集和DIA分析。结果显示,在所有重复中鉴定了36,000个不同的diGly肽,其中45%和77%的变异系数(CVs)分别低于20%和50%(图2a–c)。6个DIA实验产生的不同的diGly肽比相应的DDA实验多24,000个。
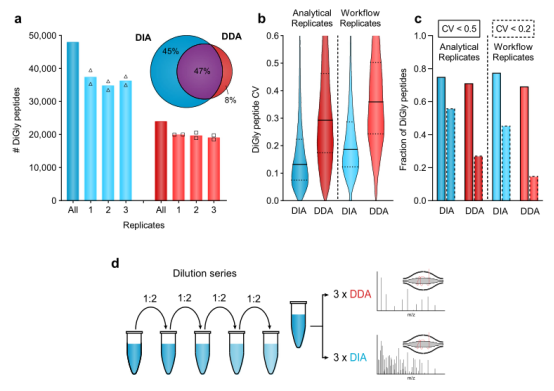
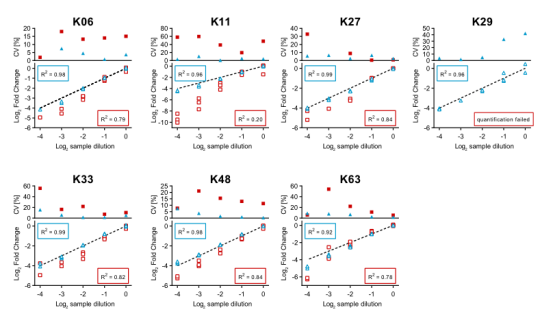
图2 用于DIA定量的准确且可重复的diGly蛋白质组学。(a)用于DIA(蓝色,HEK293混合库)和DDA(红色)策略(n=6,三个工作流程重复)的已识别diGly肽的数量(平均值,n=2); (b) 变异系数值分布的直径和数据分析方法。实线和虚线分别表示中位数和第一或第三分位数; (c) CV值低于50%和20%的分数分别用实线和虚线表示; (d) diGly富集样品的稀释系列。
使用DIA和DDA方法分别对diGly样品(泛素链连接衍生的diGly肽)进行分析,进一步确认以上方法的定量精准度和准确性。结果表明,DIA方法评估的所有七种链肽的R2值高于0.92,远高于DDA的相应值(R2 0.20–0.84),如图2d所示,量化结果也显示了DIA斜率比DDA更接近1。这些结果证明了DIA方法比DDA能够识别更多diGly肽的数量,同时显著地提高了量化的精准度和准确性
3. TNF信号通路的泛素化修饰组学分析
对TNF(肿瘤坏死因子)刺激的U2OS细胞中超过10,000个diGly位点进行量化,结果表明,DIA和DDA两种方法量化的泛素化位点数量相近(DIA中10,300个,DDA实验中9500个,图3b)。然而,DIA实验得到248个显著上调泛素化位点(5%FDR,中值折叠变化2.5),其中37个定位于已知参与TNF/NFκB信号传导的23种蛋白质(图3c),但DDA方法仅鉴定出38个显著上调的泛素化位点(5%的FDR,中值折叠变化4.1),其中15个定位于7个TNF/NFκB信号蛋白。
以往的研究表明,肿瘤坏死因子信号通路的几个成员参与病毒的感染,肿瘤坏死因子受体的阻断增加了对病毒感染的易感性。通过生信分析发现“病毒过程”在的DIA分析中显著富集,但在DDA分析中并不显著(图3d)。此外,DIA分析还揭示了LUBAC复合物的所有成员-HOIP/RNF 31、HOIL-1/RBCK 1和Sharpin-的调控泛素化(图3e)以及TNF调控的许多蛋白质的泛素化。
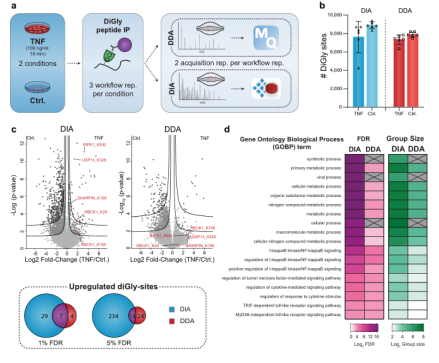
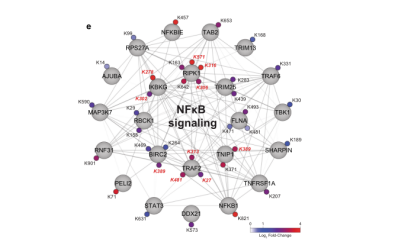
图3 DIA可提供TNF调控的泛素化修饰组学的详细视图。
4. 昼夜节律受泛素化调控
哺乳动物中的生物钟是由连锁的转录-翻译反馈回路驱动的,在细胞和组织水平上,它们调节基因表达、蛋白质丰度和翻译后修饰的振荡,泛素化在核心时钟机制中起着关键作用。考虑到磷酸化介导的信号转导在体内被临时调控的程度,作者为了了解泛素化是否也表现出类似的振荡而对U2OS细胞(一种研究细胞自主昼夜节律的模型)进行蛋白质组和泛素化修饰组分析。
结果显示,获得的10,886个泛素化位点对应于3238种蛋白质(图4b),而蛋白质组中共有7590种蛋白质被定量,其中最多有143种蛋白质发生了振荡(q值< 0.33)。此外,周期性分析表明,18%的蛋白质上8%的泛素化位点以昼夜节律方式振荡(图4c);过表达分析显示,被注释为膜蛋白(59%)的蛋白质主要参与小分子的运输,如离子、胺和有机酸(图4d),有四分之一的节律性泛素化蛋白质包含一个以上的振荡位点(150个位点;图4e)。研究还发现了一些相邻位点大多位于具有潜在调节功能的区域,如不依赖胱氨酸-谷氨酸钠转运体(SLC7A11,501 AA)的K4、K30和K37有节奏地泛素化且具有相似的阶段(分别为13.8、13.3、13.1 h,图4f)。另外,在MAGED1的MAGE结构域中发现了新的振荡泛素化修饰(MAGE D1是一种直接与核心时钟蛋白RORα相互作用的蛋白质,用于调节Bmal1、Rev-erbα和E4bp4基因表达(图4g)),研究结果确定了MAGED1的活性可以通过其MAGE结构域中的多重泛素化以翻译后的方式有节奏地控制。
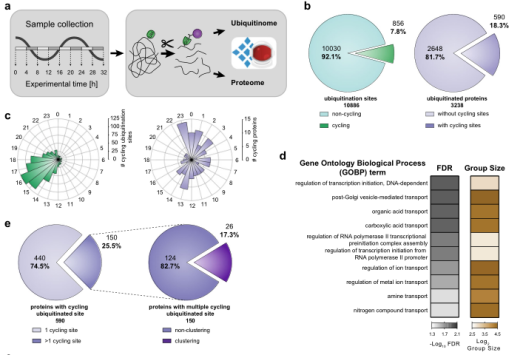
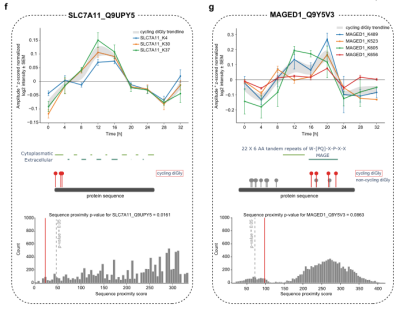
图4 节律性泛素化修饰组学定量分析。(a)实验流程;(b)振荡泛素化位点(q<0.1)在大于50%的所用样本中的比例(左图,绿色)和具有循环泛素位点的蛋白质(q<0.1)(右图,紫色);(c)玫瑰图显示循环泛素化位点(左面板,绿色)和蛋白质(右面板,紫色)的相位峰;(d)基因本体生物过程(GOBP)的过表达分析过滤前十个术语;(e)具有单一和多个循环泛素化位点(左面板)和显示循环diGly位点簇(右面板)的蛋白质比例;(f)(g)循环泛素团簇的邻近分析实例。
结论:
作者开发了一种灵敏且稳定性好的基于 DIA 的工作流程,该方法比DDA具有更大的优势、更高的通量以及更高的稳定性和准确性,将基于diGly抗体的富集和优化的基于 Orbitrap 的DIA与包含超过90,000 种diGly肽的综合光谱库相结合,应用于TNF信号研究,工作流程全面捕获已知位点,同时添加许多新位点。对整个昼夜节律周期中泛素化的深入、全系统研究后发现数百个循环泛素化位点和单个膜蛋白受体以及转运蛋白中的数十个循环泛素簇,突出了新陈代谢与昼夜节律调节之间的新联系。
连接:https://www.nature.com/articles/s41467-020-20509-1

严谨对待每一次生物质谱
微信号|trans-omics
官网|www.mhelix.cn
咨询 | 021-2027 3656















