3月《自然》杂志上刊登了一项来自瑞士巴塞尔大学的研究,Michael N. Hall带领的研究团队发现了一种全新的抑癌蛋白LHPP:该蛋白的缺失促进了肿瘤的生长,增加其表达则能够有效抑制癌细胞增殖并阻止肝功能损伤。同时,肝癌的严重程度或患者的预期寿命与LHPP 的水平高度相关;当LHPP彻底消失,肝癌患者的平均寿命会缩短2年。也就是说,LHPP同时可作为癌症诊断分子标志物和预后指标。

不仅经典的mTOR的发现出自该团队之手,于1991年揭示了其细胞生长调控作用以及在癌症、肥胖、糖尿病和心血管疾病发展中的重要抑制作用;时下再次通过蛋白质组学筛选配合功能验证、临床筛选,成功揭示了磷酸酶LHPP。
小鼠建模
通过敲除PTEN和TSC1基因,激活mTOR信号通路,小鼠在6周出现肝肿大,20周发展为肝细胞癌。该模型小鼠被命名为“肝脏特异性双敲除小鼠”(liver-specific double-knockout , L-dKO),针对肿瘤标志物的mRNA表达水平进行分子分型等手段确证模型靠谱。
定量蛋白质组
12例肝脏肿瘤组织样本和对应模型组的定量蛋白质组学分析中,鉴定到4500种蛋白,其中433种蛋白显著上调表达,262种显著下调表达。

数据分析筛选
三种组氨酸激酶发生显著变化,其中NME1和NME2显著上调;LHPP显著下调。而NME1和NME2受mTOR的激活所调控,LHPP并不受其控制。
关键蛋白验证
为了确证LHPP、NME1、NME2等蛋白确实与肿瘤发生或mTOR激活等相关,研究者以年龄性别匹配的小鼠为对照,检测了L-dKO模型小鼠不同时期的肝脏组织(6、12、16周)和肿瘤组织(20周)中LHPP的含量变化。结果显示,在16周L-dKO小鼠发展出肉眼可见的肿瘤时,LHPP含量出现轻微下降。20周发展为HCC时,LHPP含量显著下降。
动物功能
研究者进一步利用腺病毒转染,在8周的健康小鼠和L-dKO小鼠分别尾静脉注射AAV-control和 AAV-LHPP。结果表明,注射外源LHPP可在20周时明显抑制肿瘤细胞的大小和数量。
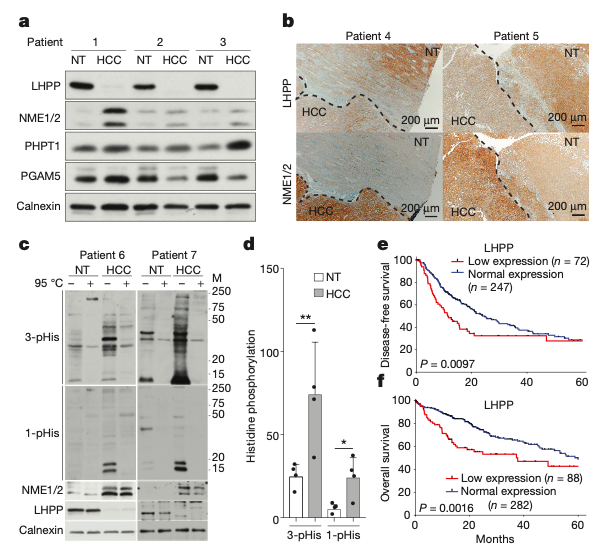
临床数据
为了排除小鼠模型与人HCC发生机制的不同,研究人员对20个HCC患者的肿瘤组织和对应健康组织进行组织芯片分析,发现肝癌患者同样表现出LHPP低水平表达。同时TCGA和ICGC在录的数据中也印证了一表达水平的变化,并且LHPP低表达的患者中位生存期减少了近2年。
参考文献
Sravanth K. hindupur, et al. The protein histidine phosphatase LHPP is a tumour suppressor. Nature. (2018) 10.1038














