
14对CRC患者和健康人的宏蛋白质组
上海复旦大学乔亮教授的团队在疫情期间发表了一项值得关注的大肠癌(CRC) 发病机制的研究成果。他们对收集到的大肠癌患者和健康志愿者的粪便样本,借助宏蛋白质组定量标记的策略对微生物组进行表征,完成了30,062个肠道微生物蛋白的和195个微生物属的鉴定。在这些蛋白质中,发现341个大肠癌患者和健康志愿者的丰度显着不同,其中涉及:铁摄入/转运、氧化应激、DNA复制、重组和修复相关的微生物蛋白,这与CRC患者大肠内高浓度的铁和高氧化应激密切相关。
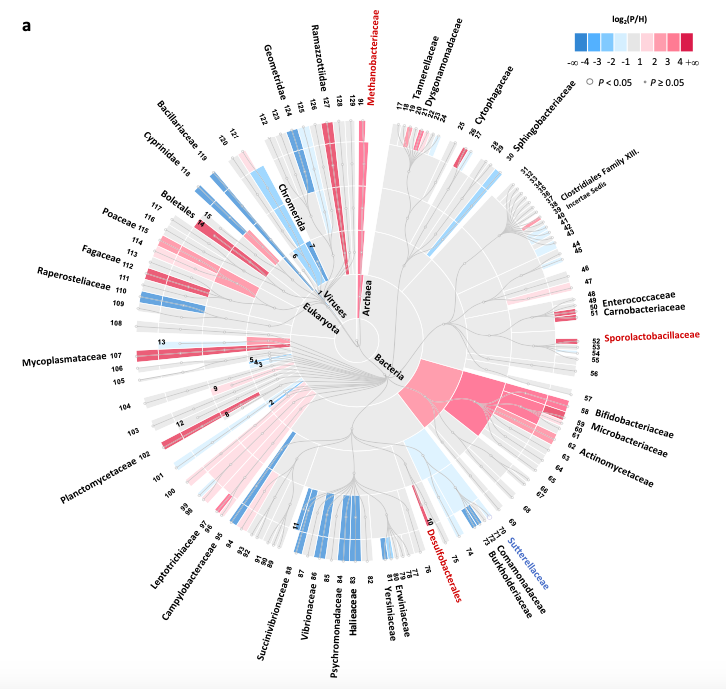
肠道微生物组分类
在14对CRC患者/健康人的341个高度差异蛋白微生物蛋白中:124个在大肠癌患者中更为丰富,217个则在健康对照组中表现更为丰富。P/H变化倍数(FC)最大的10个蛋白来自嗜臭杆菌属、真细菌属、亚种嗜臭杆菌属、拟杆菌属和瘤胃球菌属,以及梭状芽孢杆菌属。嗜臭杆菌中变化蛋白涉及DNA结合、DNA整合和DNA重组。P/H变化倍数(FC)最小的10种蛋白质来自普氏菌、拟杆菌、Lachnospira、厚壁菌、副细菌、Gordonibacter和梭菌,如下图。这些蛋白质与蛋白质折叠、跨膜转运、天冬酰胺代谢、RNA结合或脂多糖合成有关。
CRC发病机制与诊断标志物
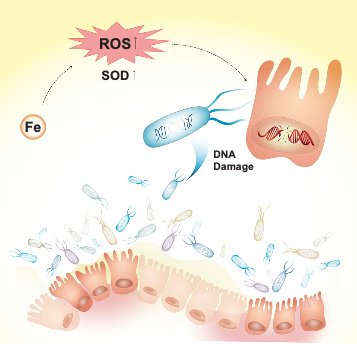
蛋白数据与过去关于红肉摄入导致大肠癌风险增加的报道高度一致,同时清除游离铁可以抑制结直肠癌细胞的生长。另外,CRC患者肠腔高铁浓度促进活性氧(ROS)的产生,导致高氧化应激。肠道细菌中超氧化物歧化酶(SODs)的浓度增加。过量的ROS可引起肠上皮细胞和益生菌DNA损伤,加速CRC的发生发展。
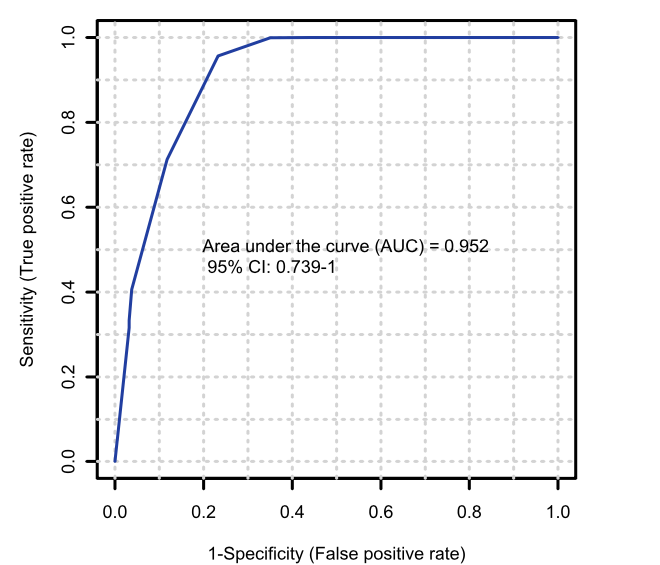
与此同时,通过LSVM分类和ROC曲线交叉验证,高变化的20种肠道微生物蛋白可以作为诊断大肠癌的候选生物标记物。
过去关于微生物组的表征分析主要集中在宏基因组的结论中,对大肠癌患者肠道菌群功能的变化仍然未知;本次研究为复杂疾病与微生物关系的认知打开了一个新的视野。
参考文献
Shuping Long, Yi Yang, et al. Metaproteomics characterizes human gut microbiome function in colorectal cancer. NPJ Biofilms and Microbiomes volume. (2020) 14














