Nature最近发表的A metabolite-derived protein modification integrates glycolysis with KEAP1-NRF2 signaling文章,揭示了糖酵解关联信号的转导机制研究。细胞代谢和信号调节整合对于维持细胞稳态是极其必需的。细胞内生、固有活性代谢物能够调节蛋白质功能,进而影响细胞的生命活动。KEAP1是一种重要的“亲电性传感器”蛋白,可对内源性和外源性分子做出反应,其共价修饰会导致 NRF2 的累积,从而启动细胞保护基因转录。因此,本文揭示了糖酵解和NRF2信号传导之间的直接联系。
1.IMR32细胞表型筛选,确定激活 NRF2信号传导的化合物
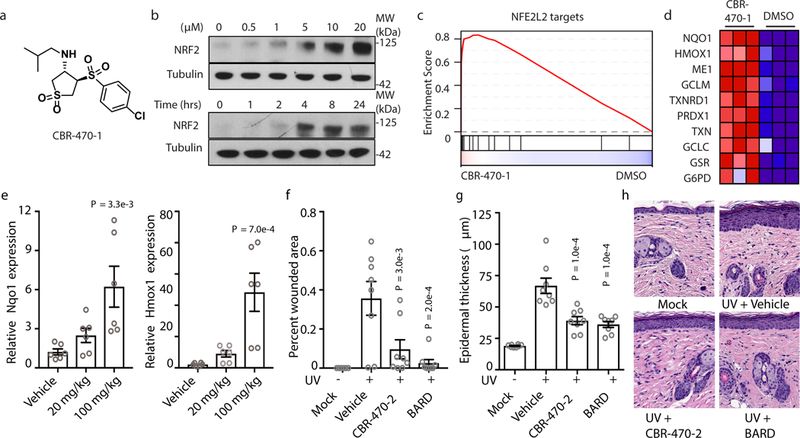
为了发现KEAP1-NRF2信号传导途径的非共价调节因子,以及其潜在调节的新作用机制,本文使用NRF2依赖性荧光素酶报告基因(pTI-ARE-LUC)进行了基于IMR32细胞的高通量表型筛选。从多种杂环化合物库中,作者鉴定到一种CBR-470-0化合物,其系列化合物(如CBR-470-1)处理IMR32细胞后可导致NRF2蛋白的积累呈现时间依赖效应(图1b)。根据IMR32细胞(CBR-470-1处理24h后)表达谱显示,最显著富集的基因组是由NRF2靶基因组成的“NFE2L2 targets” (图1c-1d),这表明CBR-470-系列化合物可以在体外诱导NRF2信号通路激活。
接下来,本文进一步确定CBR-470-系列化合物参与体内的诱导过程。Balb/C小鼠口服CBR-470-2化合物,通过qRT-PCR检测在几个器官中NRF2靶基因的表达情况,发现在皮肤中观察到NQO1和HMOX1的转物水平呈现剂量依赖性增加(图1e)。已有研究表明NRF2可以有效防止紫外线照射导致的光老化表型和皮肤癌变,进而作者在急性UV损伤小鼠模型中评估CBR-470-2的活性,发现CBR-470-2可以减少紫外线照射后的小鼠模型表皮厚度,与NRF2细胞保护程序的激活一致(图1g-1h);由此表明CBR-470-系列化合物可以在体内诱导NRF2信号通路激活。
1.IMR32细胞表型筛选,确定激活 NRF2信号传导的化合物
为了发现KEAP1-NRF2信号传导途径的非共价调节因子,以及其潜在调节的新作用机制,本文使用NRF2依赖性荧光素酶报告基因(pTI-ARE-LUC)进行了基于IMR32细胞的高通量表型筛选。从多种杂环化合物库中,作者鉴定到一种CBR-470-0化合物,其系列化合物(如CBR-470-1)处理IMR32细胞后可导致NRF2蛋白的积累呈现时间依赖效应(图1b)。根据IMR32细胞(CBR-470-1处理24h后)表达谱显示,最显著富集的基因组是由NRF2靶基因组成的“NFE2L2 targets” (图1c-1d),这表明CBR-470-系列化合物可以在体外诱导NRF2信号通路激活。
接下来,本文进一步确定CBR-470-系列化合物参与体内的诱导过程。Balb/C小鼠口服CBR-470-2化合物,通过qRT-PCR检测在几个器官中NRF2靶基因的表达情况,发现在皮肤中观察到NQO1和HMOX1的转物水平呈现剂量依赖性增加(图1e)。已有研究表明NRF2可以有效防止紫外线照射导致的光老化表型和皮肤癌变,进而作者在急性UV损伤小鼠模型中评估CBR-470-2的活性,发现CBR-470-2可以减少紫外线照射后的小鼠模型表皮厚度,与NRF2细胞保护程序的激活一致(图1g-1h);由此表明CBR-470-系列化合物可以在体内诱导NRF2信号通路激活。
2 .CBR-470-1激活NRF2信号传导的机制
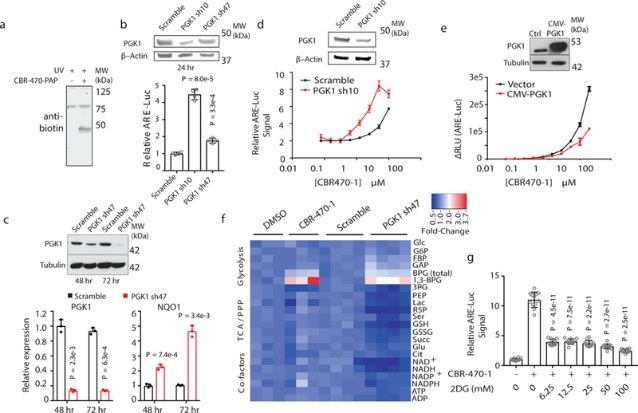
为了确定CBR-470-1激活NRF2信号传导的机制,作者合成了含有生物素和二氮杂萘取代基的荧光亲和探针(称为CBR-470-PAP),并使用5μM剂量去处理IMR32细胞1小时,在紫外线照射后进行细胞裂解液的抗生物素蛋白质印迹分析(图2a);再接着通过生化分离和LC-MS/MS分析磷酸甘油酸激酶1(PGK1)是否作为CBR-470-PAP的潜在靶标(图2b-2c)。体外重组蛋白的结合实验表明CBR-470-PAP选择性标记了PGK1;而IMR32细胞中PGK1蛋白的敲低和过表达实验发现,CBR-470-1处理组的 EC50值分别表现出降低和增加(图2d-2e),且烯醇酶1(PGK1下游的酶)消耗加快;靶向代谢物组学分析发现,CBR-470-1处理的IMR32细胞中PGK1 上游代谢物水平快速增加以及下游代谢物快速消耗;上述结果表明,糖酵解中间体可参与NRF2信号传导,CBR-470-1可通过调节PGK1活性来影响糖酵解途径和NRF2活化过程。
3.MGx介导了糖酵解和KEAP1-NRF2信号通路的直接联系
在CBR-470-1处理IMR32细胞30分钟后,1,3-BPG水平升高,KEAP1水平没有明显改变;但是WB结果显示CBR-470-1发生作用依赖于高分子量 KEAP1(HMM-KEAP1)的形成,其分子量大约是单体 KEAP1 的两倍(图3a)。除1,3-BPG外,其他糖酵解的中心代谢产物,如磷酸丙糖异构体D-甘油醛-3-磷酸(GAP)和磷酸二羟丙酮(DHAP),以及它们的非酶解产物甲基乙二醛(MGx),这些亲电羰基化合物都可以作为反应官能团修饰蛋白残基。在这些候选物中,仅有MGx处理的细胞裂解物或活细胞可导致HMW-KEAP1的选择性形成(图3b-3c),并功能性地激活下游NRF2靶基因NQO1和HMOX1的表达(图3d);同时衍生化MGx的靶向LC-MS检测也证实CBR-470-1处理细胞的最初几小时内MGx水平显著地升高(图3e)。因此上述结果说明糖酵解和由MGx直接修饰KEAP1介导的KEAP1-NRF2信号通路之间存在直接联系。

综上所诉,发现糖酵解代谢过程是通过反应性糖酵解代谢物MGx与前哨蛋白KEAP1的直接相互作用来偶联NRF2依赖性基因的表达,并形成稳定且新型的翻译后修饰蛋白质来介导糖酵解途径














