阿尔茨海默症(Alzheimer's disease, AD)是一种起病隐匿的进行性发展的神经退行性疾病,其主要病理学特征是淀粉状斑块(Amyloid Plaques, APs)在脑部的沉积。阿尔茨海默症由于致病机理复杂,病程长且发病隐秘等原因,被认为是所有治疗领域中研发成功率最低的疾病。过去20年来针对神经退行性疾病的药物研究几乎全军覆没,众多制药巨头的多个单抗药物均在III期临床惨遭失败,这为阿尔茨海默氏症的新药研发领域蒙上了层层阴云。
近日,一篇题为Quantitative proteomics reveals distinct composition of amyloid plaques in Alzheimer's disease 的研究论文被发表在阿尔茨海默症专业期刊Alzheimer & Dementia (IF=12.7)上。研究人员通过激光显微切割与高通量定量质谱的技术研究了AD人脑、年龄匹配的非AD人脑、以及APP/PS1转基因模型小鼠中APs的蛋白组学特征。研究鉴定了40余种高度富集于人脑APs的蛋白组分,并详细阐述了人脑与模型小鼠脑的异同。
下面对文章进行一个简单的解读:
研究疾病:阿尔茨海默症
样本:人脑、小鼠的脑组织
研究策略:TMT定量蛋白质组学
发表期刊:Alzheimer's & Dementia(IF:12.7)
发表单位:基础医学研究所
发表时间:2018.12
新药的研发临床前需要通过模型小鼠进行药效评估,而针对APs研发的药物虽然能够改善模型小鼠的认知水平,但是在临床实验中并未取得实质性的效果。另一方面,淀粉状斑块的沉积不仅仅在AD病人中存在,在人随着年龄增长中也会出现。因此,系统性的比较研究人脑APs的组分至关重要。
本文通过蛋白质组学技术方法比较AD病人,正常人及APP/PS1转基因模型小鼠间APs区域蛋白质水平的差异,及不同年龄阶段大脑组织蛋白质水平的差异,对AD疾病病理机制进行了新的阐述,为AD疾病未来治疗方向奠定了基础。
1 APs蛋白质组学数据评估
研究团队选取了三个AD病人和三个同年龄段的非AD人群脑部海马体组织的斑块(plaque capture);12个无神经性疾病不同年龄阶段海马体和颞叶进行大脑年龄阶段发育蛋白质组学研究。AD病人和非AD人群HC组织中APRs(AP regions)和NPRs(nonplaque region)在冰冻组织通过荧光染色后确定,采用激光切割(LCM)技术获得(图1A)。小鼠的AD模型采用APP/PS1(过表达amyloid precursor protein 和human presenilin 1基因突变)双转基因模型进行对应蛋白质组学分析。
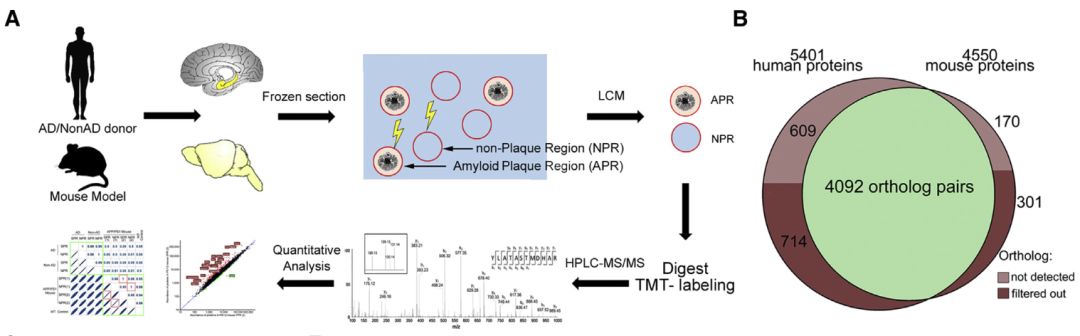
图1. 人和APP/PS1小鼠模型APs蛋白质组学研究思路
研究者运用定量蛋白质组学技术对样本进行检测,通过比较小鼠和人之间同源性蛋白,发现4092个蛋白在所有样本中被检测到,占总鉴定蛋白的80%左右。1323个人类蛋白和471个小鼠蛋白没能在人和小鼠中得到共同匹配 (图1B)。
研究人员为了确定蛋白质组学数据质量,通过GOCC聚类分析,数据显示人和小鼠的蛋白质组学数据表现相类似(图2C-E)。此外参与神经元结构的蛋白占比很高,有大于60%的神经元结构相关蛋白被鉴定出来(图2E),说明蛋白质组学数据神经蛋白覆盖率很高,可以进行后续分析。
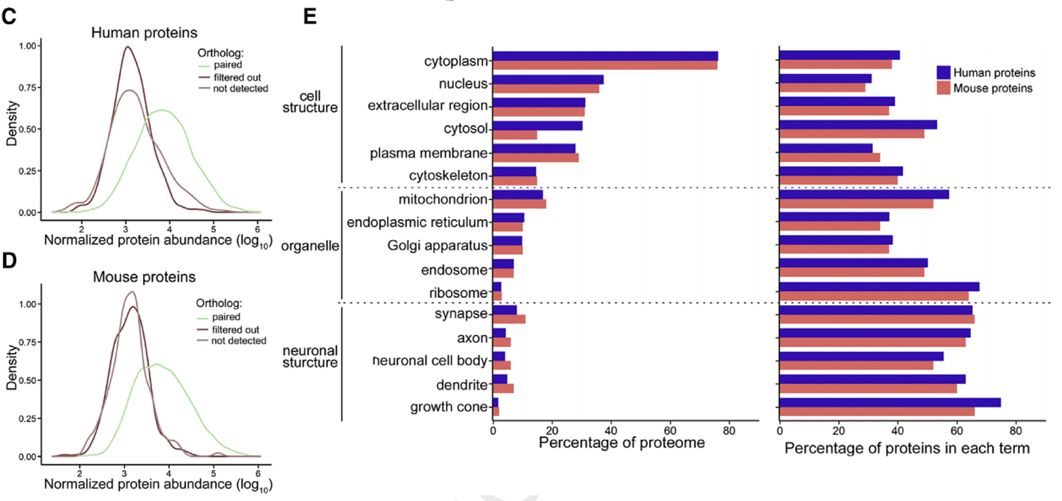
图2. 人和APP/PS1小鼠模型APs蛋白质组学研究思路
2 AD病人和小鼠APs存在差异性调控途径和生物进程
通过AD病人,非AD人,APP/PS1转基因小鼠脑部斑块组织与相对应的非斑块组织蛋白质组学数据比较,发现每种类型APs对应的蛋白质水平差异显著,许多蛋白在AD病人的APs区域表现出较正常人APs区域明显上升,且AD病人APs蛋白质水平差异显著不同于APP/PS1转基因小鼠模型APs。
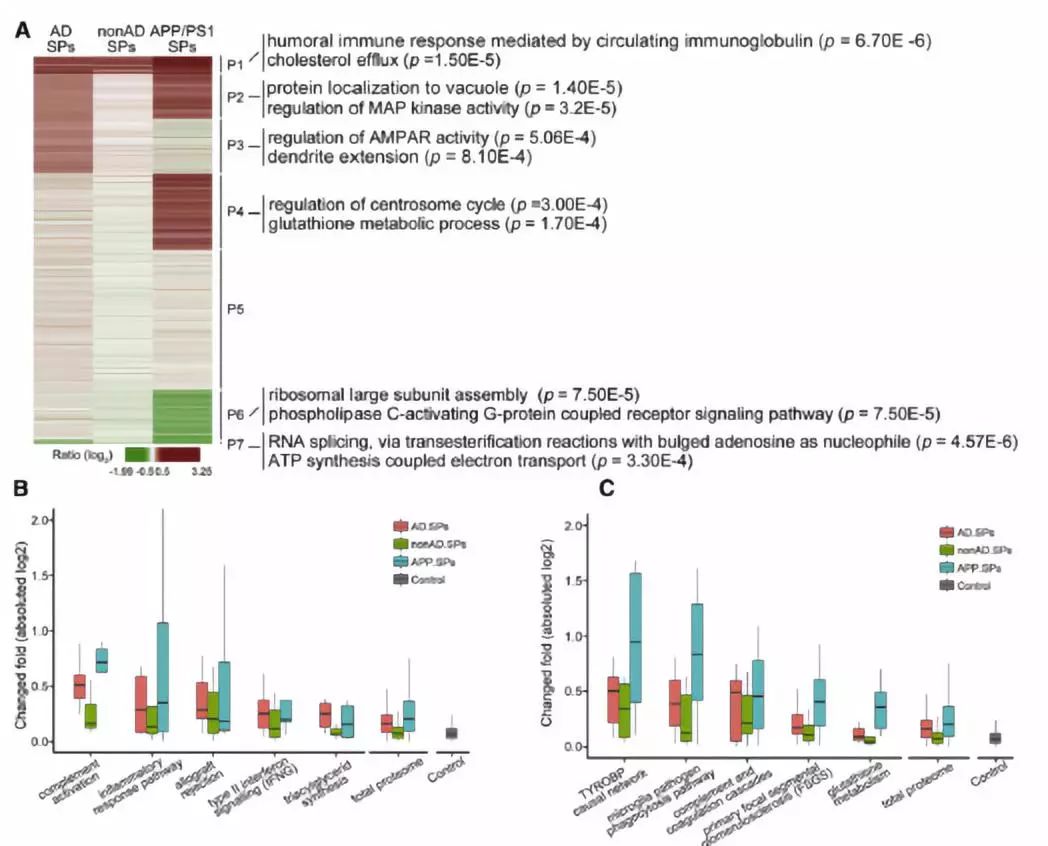
图3 AD病人与APP/PS1的APs不同的调控途径和生物进程
研究人员通过通路和GO聚类将差异性蛋白分为7类,每部分蛋白在GOBP富集的通路主要集中在两类(图3)。AD病人中变化最显著的5个通路(图3B),其中补体激活最显著,其次是炎症反应途径,而其通路相对于其他APs表现并不明显。通过比较,APP/PS1 小鼠APs较AD病人和非AD人群APs蛋白通路差异更明显,包括以往报道TYROBP(TYRO蛋白酪氨酸激酶结合蛋白, TYRO Protein Tyrosine Kinase Binding Protein)因果网络和小胶质细胞病原体吞噬途径(图3C)。小鼠模型APs区域这些通路蛋白差异倍数普遍高于人APs区域,甚至一些通路只在小鼠APs区域中发生改变,如谷胱甘肽代谢。
研究者通过蛋白组学数据分析表明,非AD人群APs区域与AD病人APs区域中的斑块沉淀调控机制较为类似,而AD病人和APP/PS1转基因小鼠的APs的斑块沉积是通过不同的信号通路调控。
3 不同蛋白和多肽与AD病人和转基因小鼠模型关系分析
通过人和小鼠间同源性蛋白表达丰度进行相关性计算表明,在AD病人, 非AD人群和小鼠大脑蛋白表达水平存在高度相关性(>0.95,而人和小鼠间蛋白相关性大约为0.9)。为证实海马APs组织之间蛋白差异性的关系,研究人员进一步从三个方面进行了数据的论证:比较了APRs和对应的NPRs的蛋白丰度(图4A-C);比较AD病人和非AD人群 NPR区域的蛋白质丰度;蛋白网络互作分析展示AD病人与APP/PS1转基因小鼠APs区域间差异蛋白之间关系。
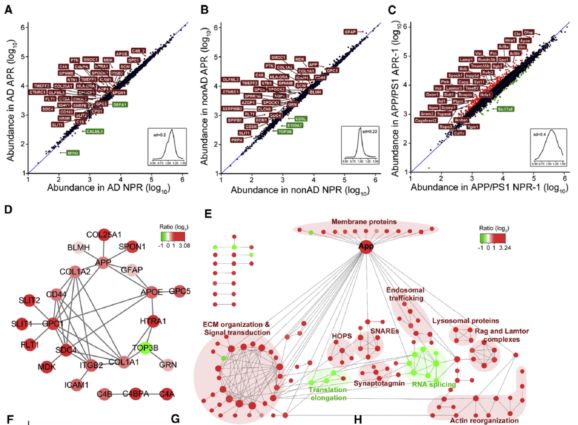
图4. AD疾病相关蛋白特征特性
4 随着年龄老化,人APs区域相关蛋白水平上升
研究人员最后研究了年龄和APs形成的关系。依据大脑年龄将样本分为三类(年轻群体:34 ± 13Y ;中年群体:62 ± 5Y;老年群体84 ± 4Y)。来自不同组的野生型小鼠同样按照这种方式分类(年轻组:20周;中年组:60周;老年组:120周)。结果表明人和小鼠大脑APs区域之间,随着年龄的变化呈中等正相关(P~0.34-0.52),与HC或TL区域呈弱相关(<0.3)。结果表明在年龄增长变化过程APs区域蛋白质变化与HC或TL并没有相关性。但是,APs蛋白质组学数据的P1类蛋白(仅富集在非AD病人APs)在中年组后HC区域显著性增长(图5B-C),而仅在AD病人 APs区域改变的P2,P3类蛋白在随年龄增长中HC区域并没有发生差异变化,表明老年的P1蛋白的积累限制在人的HC区域,P1蛋白的积累可能有助于APs沉淀,但并不会引起AD病理发生。
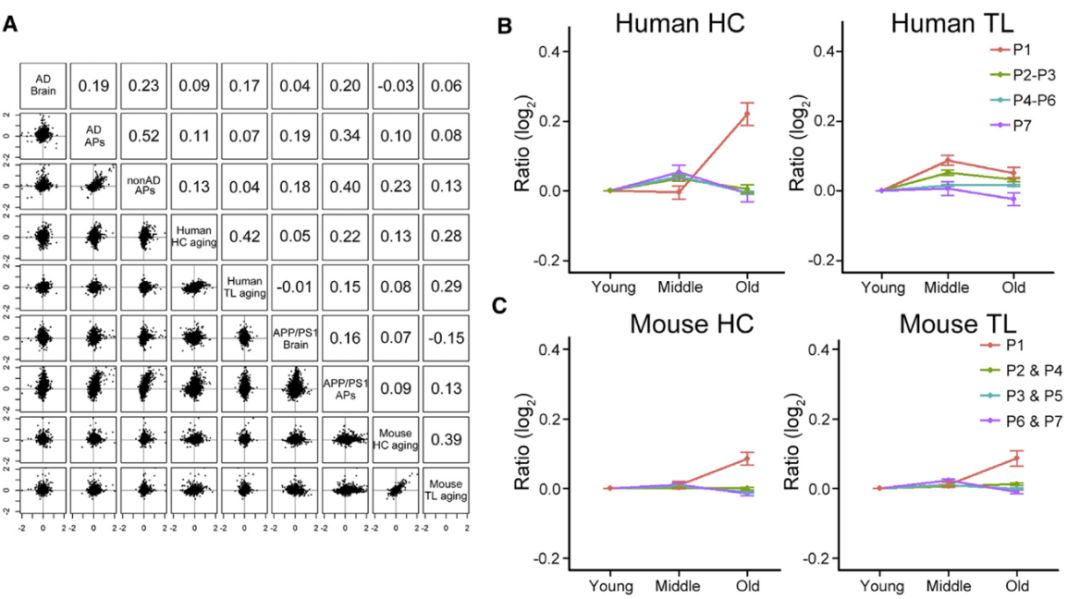
图5. 随着年龄增加人大脑APs区域蛋白表达上升
最后研究人员根据APs的变化模式将上升蛋白进行分类后进行蛋白网络互作分析,发现差异性蛋白是以 APP和EGFR蛋白为中心性,在AD病理和年龄老化中都起到了重要作用。
综上所述,文章通过蛋白质组学手段分析了脑部老年斑组织在AD病人,非神经性疾病人群和APP转基因小鼠模型中蛋白质水平的差异,揭示出了小鼠APP模型AD病理特征不同于人类AD病理,为AD新药研发提供了一个新思路。
参考文献
Xiong F, et al., 2018, Quantitative proteomics reveals distinct composition of amyloid plaques in Alzheimer’s disease. Alzheimer's & Dementia.














