2016年Gygi课题组发表了题为Highly Multiplexed Quantitative Mass Spectrometry Analysis of Ubiquitylomes的文章。文中作者开发了使用等重同位素标记联合肽段捕获的方法,对泛素化组进行系统性的鉴定,并揭示了在线粒体自噬过程中的PINK1和PARKIN依赖性的泛素化。
泛素修饰系统的核心特征是其动态性。诸如磷酸化等细胞信号可以促进泛素修饰系统地活化,帮助修饰系统识别靶标蛋白;或是通过去泛素化酶从修饰蛋白上除去泛素;以及通过其他方式进行调节。尽管这些细胞调控途径已被人们所熟知,但很少能够有报道去定量地解析特定蛋白质的泛素化状态和蛋白质中特定的泛素化位点的改变,以及在遗传缺陷的背景下信号通路中的泛素化修饰的变化。此外,人们对于泛素化组在不同组织中的差异同样知之甚少。产生这些限制因素的原因在于,缺乏对泛素化修饰进行简便定量的分析方法。用于阐明泛素信号通路中泛素化肽段的传统定量方法主要是基于质谱的非标记定量[1]和代谢标记定量[2,3],与diGlycine残基抗体(anti-K-ε-GG remnant antibody)富集方式相结合,从胰蛋白酶消化的蛋白质中捕获泛素化肽段[4]。然而,使用这些方法需要使用多重纳升液相串联质谱(nLC-MS/MS),不仅限制了样品中所能定量到的泛素修饰肽段的数量,而且通常需要大量的起始量(每个样品5-40mg)。使用diGlycine残基抗体捕获肽段时,存在潜在随机取样,这一点可以被生物学重复实验中鉴定的diGlycine修饰肽段不完全重叠所证明。等重同位素标记有利于减少样品所需的起始量,因为在进行质谱检测之前样品中的肽段将被混合在一起并且在质谱中显示为一个峰。此外,等重同位素标记对多个重复之间进行平行鉴定,减小了仪器检测差异造成的缺失值。然而化学标签标记diGlycine残基的伯氨,使得被标记的样品无法通过diGlycine残基抗体进行富集。如果使用diGlycine残基抗体进行富集的变异性足够低(比如说变异系数CV<10%),则可以利用等重同位素标记对细胞培养、组织和临床样本的泛素化组进行深度地多重定量。在本文中,作者使用了等重同位素标记与diGlycine富集相结合的方法来描述细胞和组织中泛素化组的变化,很大程度地克服了当前非标记定量和代谢标记定量存在的限制。利用此方法,作者验证了线粒体中泛素化PARKIN和PINK依赖性的线粒体自噬,体现了该方法的实用性。
作者使用DMSO(对照)和蛋白酶体抑制剂bortezomib(Btz)处理HTC116细胞,然后LysC/Trypsin酶解裂解细胞所得蛋白,切除泛素修饰并释放出diGlycin残基,用diGlycine残基抗体富集修饰肽段,然后用10标TMT标记富集后的肽段。为了避免抗体富集和等重同位素标记造成的差异性,酶解产生的肽段被均分为5个技术重复,每个重复含1mg的初始肽段。混合之后用高pH反相色谱将肽段分为6个级份,然后通过SPS MS3进行定量鉴定(图1A)[5](传统的iTRAQ和TMT标记均使用MS2碎片报告离子来进行定量,但是作者先前的研究发现该方法由于母离子筛选过程易受到基质干扰,因而定量结果与真实值相比偏低,而使用MS3碎片报告离子来进行定量,则可以很好的解决这一问题)。最终,作者在18小时的分析时间(1.8小时/ 泛素化组)中鉴定了10,218种独特的修饰肽,并在10个1mg样品中定量了8801个泛素化位点(图1B),而且对于DMSO和Btz处理的样品,五个技术重复样品的中值CV分别为8.13%和6.88%(图1C)。泛素蛋白本身赖氨酸残基的泛素化修饰同样可以被定量,例如K6显著增加了2.51±0.31倍,而K48则增加了4.04±0.12倍(图1D)。层次聚类的结果表明,技术重复之间紧密聚集,绝大多数泛素化位点在蛋白酶体被抑制时,绝大多数泛素化位点大量增加(图1E),这与之前的研究结果一致。
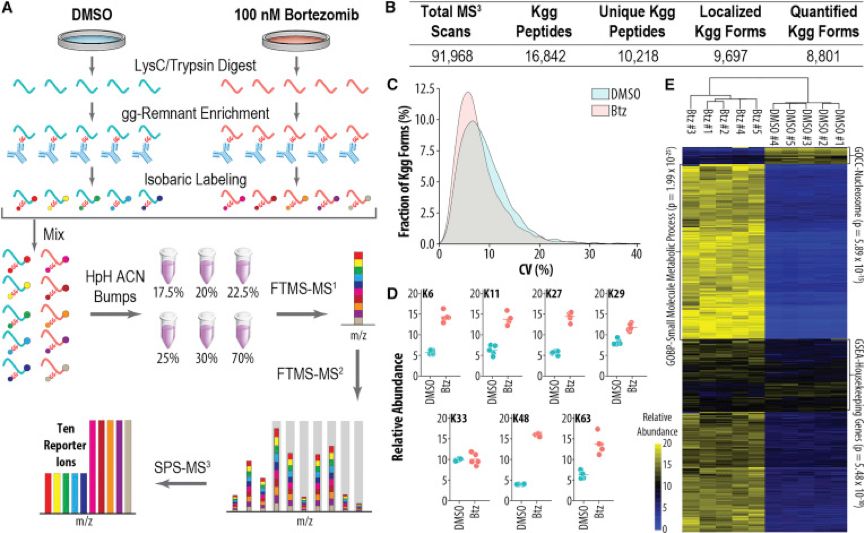
图1 利用等重同位素标记法对泛素化组进行可重复的多重定量
对于组织样本,非标定量称为代谢标记定量的常见手段,但是这通常需要较大的起始量(比如每个样品40mg),并依赖于多组实验重复测定。因此作者试图将上述的方法应用于组织样品的泛素化组研究。作者对来自大脑和肝脏7mg起始肽段的5个生物学重复进行富集,在18小时的分析时间(1.8小时/ 泛素化组)中鉴定了10,573个修饰肽段,并定量了其中的8,030个(图2A)。来自组织的生物学重复之间的定量泛素化泛素化组高度相关,五个生物学重复之间R^2≥0.89(图2C),并且大脑和肝脏的五个生物学重复的CV分别为8.08%和8.49%(图2D),说明了组织样本同样能够进行系统地泛素化组分析。为了解释蛋白表达的差异,作者对定量结果进行归一化,结果发现有一部分蛋白的多个泛素化位点表现出不同组织的特异性。其中,USP5在大脑中K163,K184,K423和K468显著增加,K20和K558在肝脏中显著增加(图2E)。同样,USP7肝脏中K935和K1037显著增加,而大脑中K421显著增加(图2F)。这些结果表明,用上述方法分析组织样品的泛素化组具有高度可重复性,并具有揭示组织特异性的泛素化修饰的潜力。此外,泛素本身的赖氨酸修饰结果与之前的实验高度吻合,且不同的连接类型修饰增加的趋势不同(图3E)。
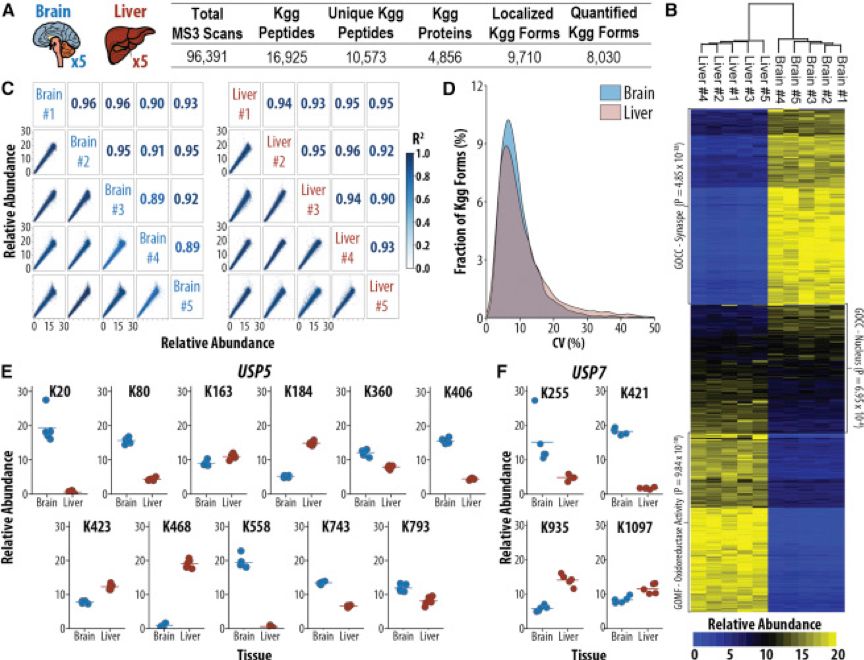
图2 多重泛素化组分析揭示组织特异性的泛素化
与代谢标记方法相比,等重同位素标记可以同时分析多达10种生物条件,允许在一个实验中分析多个时间进程的数据。HTC116是来自结肠的癌细胞系,可以用来研究与癌症途经相关的泛素化动力学。作者用Btz分别处理HTC116细胞1,2,4,6,8,10,12,14和16小时,同时以DMSO作为对照处理细胞16小时(图3A)。用1mg的起始样品,在18小时的分析时间中鉴定到了11,911个不同的泛素化肽段,并定量了其中9,036个(图3B)。随着Btz处理时间的增加,泛素化修饰位点也随之增加(图3C),主成分分析显示DMSO处理与Btz处理1小时最为相似(图3D)。正如预期的那样(图3F),Btz处理后,大多数泛素化位点增加。比如,酪氨酸激酶ERBB2 K368的泛素化在Btz处理2小时后增加4倍,处理8小时后增加了64倍。MSH6有四个泛素化位点被定量,其中两个位点K771好K852的泛素化随着时间进程增加,但是另外两个位点K476和K519无明显变化。这些结果表明并非所有位点在蛋白酶体抑制时均受到相同的调节,并且说明有些位点被选择性地修饰或者免于泛素化修饰。
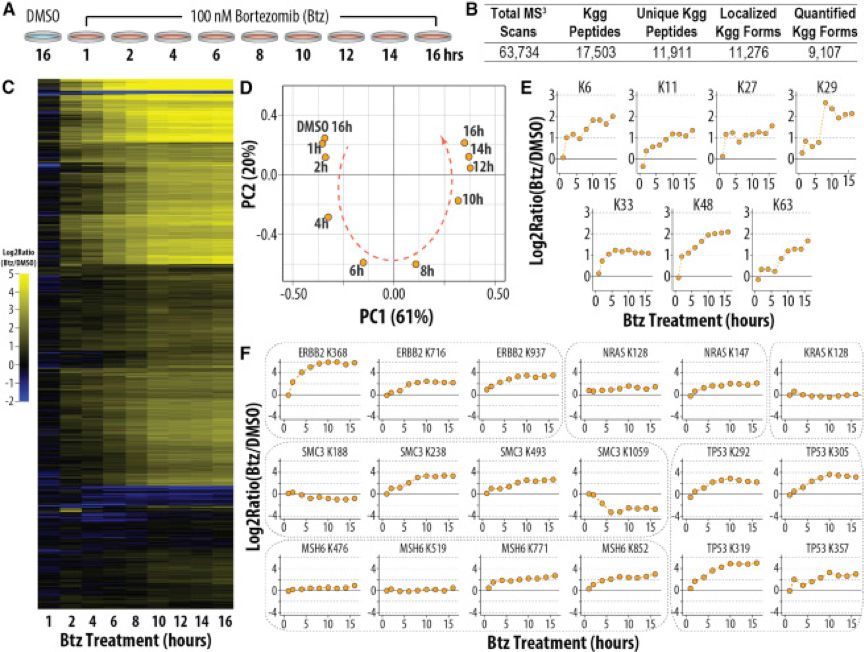
图3. 多重泛素化组分析细胞在不同时间进程对Btz的反应
等重同位素标记能够实现包括多个重复,不同时间点,和不同细胞条件在内的实验设计。作者使用等重同位素标记来表征线粒体自噬过程中的蛋白质组学和泛素化组动力学。在这个过程中,线粒体去极化导致PINK1蛋白激酶在线粒体外膜(MOM)积累,促使MOM蛋白通过PARKIN泛素连接酶泛素化。PINK1通过前馈机制激活这一过程,包括使PARKIN N端UBL结构域的S65磷酸化,激活其泛素链组装活性,以及磷酸化泛素本身的S65。pS65-UB结合并进一步激活PARKIN。这些事件最终导致了几十种MOM蛋白上主要位点的泛素化,以及K6,K11,K48和K63泛素链的组装,其中约有20%的S65被磷酸化。先前的研究表明,除了PARKIN 之外,自噬接头蛋白和其他调节蛋白也会因为线粒体的去极化而被招募到线粒体上,但是到底是哪些蛋白被招募到线粒体上是不知道的。为了了解线粒体自噬中PINK1活性和PARKIN磷酸化的作用,作者对过表达PARKINWT的HeLa细胞的分别诱导线粒体去极化0,1和6小时,然后对全蛋白以及泛素化动态图谱进行鉴定。此外,作者对过表达PARKINWT而不表达PINK1的HeLa细胞以及过表达PARKINS65A(不能磷酸化)的HeLa细胞进行鉴定。上述5组实验分别进行了两个重复,进行单针10标定量,最终鉴定到8,296个蛋白和4,817个含diGlycine的肽段,这些肽段来自于2,015个蛋白。主成分分析显示,不同重复之间有极好的重现性,并且PINK-/-,PARKINS65A和未处理的PARKINWT细胞的泛素化组比较接近。
线粒体的初步富集使用蛋白质组或者泛素化组定量,定量到了MitoCarta 2.0数据库中1158个线粒体蛋白的1001个,并且能够明确的鉴定到从细胞质被招募到线粒体的蛋白。正如所料,线粒体上的PINK1和PARKIN丰度随着去极化而迅速增加,PARKIN在PINK-/-,PARKINS65A细胞中不能被有效地招募到线粒体上,pS65-UB(以及K63也带有diGlycine修饰)可以作为PINK1-PARKIN相应去极化的活性指标。这种形式的UB在PARKINWT细胞中显著增加,但在PINK-/-和PARKINS65A细胞中没有明显增加。
PARKIN依赖性的泛素化组通过层次聚类可以明显地区分为线粒体/非线粒体泛素化,作为线粒体自噬过程中泛素化的主要底物,WT细胞中MOM蛋白的泛素化在1小时的处理时显著增加,而PINK-/-和PARKINS65A细胞则出现较少的泛素化。130种定位于线粒体的带有diGlycine修饰的蛋白质,其在去极化后1和/或6小时的丰度至少增加了1.8倍,而这种增加依赖于PINK活性或者是PARKIN S65的磷酸化。重要的是,与以前基于同位素标记的研究相比,基于等重同位素标记分析提高了泛素化位点鉴定的覆盖率。层次聚类鉴定了第二组30个线粒体内膜膜/基质蛋白,在去极化6小时后以PINK1依赖性方式泛素化,而在去极化1小时的时间点很少泛素化。此外,作者还定量到了所有之前报道的泛素结合的线粒体自噬接头蛋白,线粒体依赖PINK1和PARKIN对这些蛋白进行招募,从而促进线粒体的自噬。
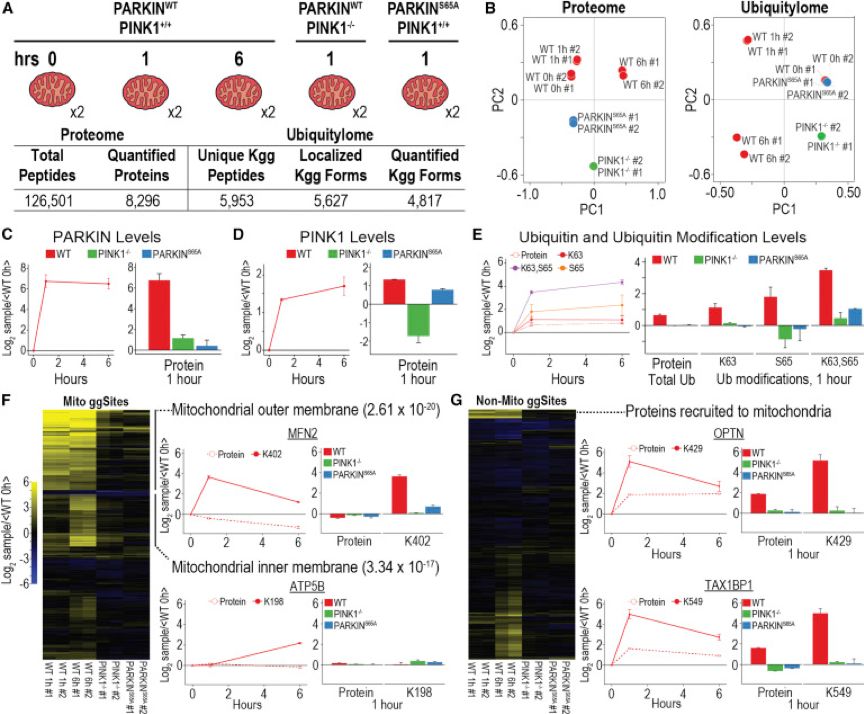
图4. 线粒体自噬过程中线粒体蛋白质组与泛素化组的动态分析
多重定量手段与细胞器富集相结合时,可以用来检测蛋白质被特定细胞器通过信号依赖性招募。而等重同位素标记的使用使得多重定量分析变得更加简单。泛素信号通路是多种细胞生物进程的核心,并与癌症、免疫、神经退行性疾病等密切相关。对泛素化动力学的大规模研究有助于人们从整体水平理解蛋白质稳态,动物模型中组织样本的泛素化组学分析,可以帮助人们更好地理解疾病中泛素化修饰的动态变化。参考文献:
[1] Yu K , Phu L , Varfolomeev E , et al. Immunoaffinity enrichment coupled to quantitative mass spectrometry reveals ubiquitin-mediated signaling events[J]. Journal of Molecular Biology, 2015, 427(11):2121-2134.
[2 ]Kim W, Bennett E J, Huttlin E L, et al. Systematic and quantitative assessment of the ubiquitin-modified proteome[J]. Molecular Cell, 2011, 44(2):325-340.
[3] Udeshi N D, Mertins P, Svinkina T, et al. Large-scale identification of ubiquitination sites by mass spectrometry[J]. Nature Protocols, 2013, 8(10):1950-1960.
[4] Ordureau A , Münch, Christian, Harper J W. Quantifying Ubiquitin Signaling[J]. Molecular Cell, 2015, 58(4):660-676.
[5] Mcalister G C , Nusinow D P , Jedrychowski M P , et al. MultiNotch MS3 Enables Accurate, Sensitive, and Multiplexed Detection of Differential Expression across Cancer Cell Line Proteomes[J]. Analytical Chemistry, 2014, 86(14):7150-7158.














